
【题目】NiCl2是化工合成中最重要的镍源。实验室常用下列装置(夹持装置已略去)制备无水NiCl2。
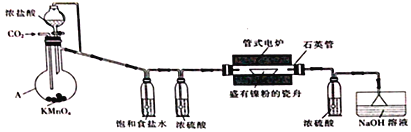
实验步骤如下:
I.按图示连接好装置,检查装置气密性后,先向装置中通入干燥的CO2。
II.约20min后,停止通入CO2,改为通儒Cl2并使装置中充满Cl2。
III.将电炉升温至750℃,在氯气流中加热约lh。
IV.在氯气流中冷却至室温后,再继续通入CO2约10min。
回答下列问题:
(1)仪器A的名称为_____________________________。
(2)步骤I中通入CO2的目的是___________________________。
(3)A中生成Cl2的离子方程式为______________________________________。
(4)判断步骤II中氧气已充满装置的现象是______________________________________。
(5)步骤IV中通入CO2的目的是______________,水槽中NaOH溶液的作用是_____________________。
(6)反应前石英管及瓷舟的总质量为m1、放入镍粉后石英管及瓷舟的总质量为m2,氧化反应后石英管及瓷舟的总质量为m3,则产品中n(Ni)/n(Cl)=________(填计算表达式)。
(7)实验室也可用NiCl2·6H2O与液态SOCl2混合加热制取无水NiCl2,其反应的化学方程式为______________________。
【答案】 蒸馏烧瓶 排尽装置内的空气(或防止空气中的氧气与镍反应等合理答案) 2MnO4-+16H++10C1-==2Mn2++5Cl2↑+8H2O 漏斗液面上方的气体呈黄绿色 排尽装置中的Cl2 吸收未反应的Cl2,以免污染环境 35.5(m2-m1)/59(m3-m2) NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl↑
NiCl2+6SO2↑+12HCl↑
【解析】氯气和金属镍加热反应制备氯化镍,氯气必须干燥纯净,因此用饱和食盐水、浓硫酸除去氯气中的氯化氢和水蒸气;由于氯气有毒,污染环境,最后要用碱液吸收处理,且要注意防止产生倒吸;金属镍能够与氧气反应,因此实验之前用二氧化碳排净装置内的空气,再用氯气排净二氧化碳气体;实验结束后,再用二氧化碳排净装置内残留的氯气,使之全部被碱液吸收;问题(6)可以根据(m2-m1)为金属镍的质量,(m3-m2)为参加反应的氯气的质量,然后转化为物质的量进行计算;问题(7)SOCl2与水反应生成二氧化硫和盐酸,抑制了NiCl2·6H2O加热时发生水解,反应生成NiCl2;据以上分析解题。
(1) 仪器A的名称为蒸馏烧瓶;正确答案:蒸馏烧瓶。
(2) 步骤I中通入CO2的目的是排尽装置内的空气,防止空气中的氧气与镍反应;正确答案:排尽装置内的空气(或防止空气中的氧气与镍反应等合理答案)。
(3)酸性高锰酸钾溶液与浓盐酸反应生成氯化锰、氯化钾、氯气和水;离子方程式为:2MnO4-+16H++10C1-==2Mn2++5Cl2↑+8H2O ;正确答案:2MnO4-+16H++10C1-==2Mn2++5Cl2↑+8H2O。
(4)由于氯气为黄绿色,判断步骤II中氯气已充满装置的现象是漏斗液面上方的气体呈黄绿色;正确答案:漏斗液面上方的气体呈黄绿色。
(5)反应结束后,装置内有残留的氯气,因此继续通入CO2,排尽装置中的Cl2;排除的氯气进入盛有NaOH溶液的水槽中,被碱液吸收,以免污染环境;正确答案:排尽装置中的Cl2 ;吸收未反应的Cl2,以免污染环境。
(6)反应前石英管及瓷舟的总质量为m1、放入镍粉后石英管及瓷舟的总质量为m2,所以金属镍的质量为(m2-m1)g,物质的量为(m2-m1)/59mol;金属镍与氯气反应:Ni+Cl2=NiCl2可知消耗氯气的量为(m3-m2)/71 mol,所以则产品中n(Ni)/n(Cl)= (m2-m1)/59:2(m3-m2)/71=35.5(m2-m1)/59(m3-m2);正确答案:35.5(m2-m1)/59(m3-m2)。
(7)SOCl2与水反应生成二氧化硫和盐酸,抑制了NiCl2·6H2O加热时发生水解,反应的化学方程式为NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl↑;正确答案:NiCl2·6H2O+6SOCl2
NiCl2+6SO2↑+12HCl↑;正确答案:NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl↑。
NiCl2+6SO2↑+12HCl↑。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:
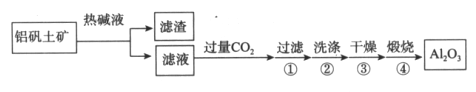
①滤液中通入过量CO2的反应离子方程式是________________。
②煅烧生成氧化铝的化学方程式是______________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以石墨衬里为阴极,石墨棒为阳极,进行电解。
①电解Al2O3能制备金属铝的原因是__________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于两性氧化物
d. Al2O3在熔融状态时能导电
②Al单质在_________极产生。
③阳极石墨棒需要不断补充,结合电极反应式,简述其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某兴趣学习小组设计如图装置制取SO2,研究其性质。
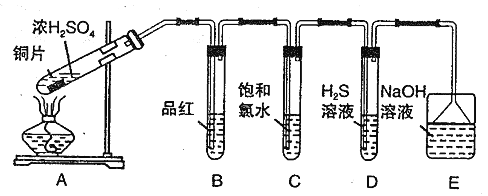
请回答下列问题:
(1)B、C、D分别用于检验SO2 的性质,写出C中反应的离子方程式_______。
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2 具有氧化性,请简述理由________________________。
(3)E装置的作用为______________。
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)_________,简述如何检验该离子______。
(5)为了测定气体Y 中SO2 的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4 的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用_______(填仪器名称)盛装;滴定终点的现象为____________。
②计算气体Y 中SO2 的物质的量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物![]() (W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:
(W是链接中的部分结构)是一类重要的功能高分子材料.聚合物是其中的一种,转化路线如下:

已知:①A中官能团不在同一个碳原子上。
②![]()
③R1CH=CHR2+R3CH=CHR4![]() R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
R1CH=CHR4+R2CH=CHR3(R表示烃基或氢原子)。
(1)B所含的官能团名称是__________。
(2)E的名称是__________,G生成H的反应类型是__________。
(3)写出D生成E的化学方程式是______________________。
(4)X的结构简式_______________。
(5)E存在多秧同分异构体,与E具有相同官能团且不能发生银镜反应的同分异构体有__________种(不考虑立体结构,不含E)。其中符合核磁共振氢谱中峰面积之比3:3:2 的结构简式________________________。
(6)以CH3CH2OH为原料(无机试剂任选)合成环丁烯,试写出合成流程图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
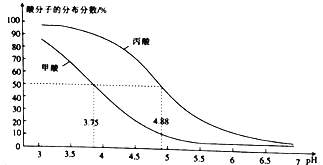
下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢主要是由铁、镍、铜、碳等元素所组成的合金。具有优异的抗腐蚀性能。
(1)铁元素在周期表中的位置是________________,其基态原子的价电子排布图为___________________,基态三价阳离子最外层有________种运动状态不同的电子。
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,Ni(CO)n晶体属于___(填晶体类型)。写出一个与Ni(CO)n中配体互为等电子体的离子的化学式为___________。
(3)已知铜晶体为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则铜晶体的密度为________________g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若铜的原子半径为r cm ,则在铜晶胞中用r表示出这种堆积模型的空间利用率为_________(保留两位小数)。
(4)邻羟基苯甲酸(又名水杨酸,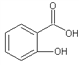 )和对羟基苯甲酸(
)和对羟基苯甲酸(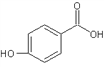 )都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(
)都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.1g平均相对分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A. 2.1g B. 3.6g C. 7.2g D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com