
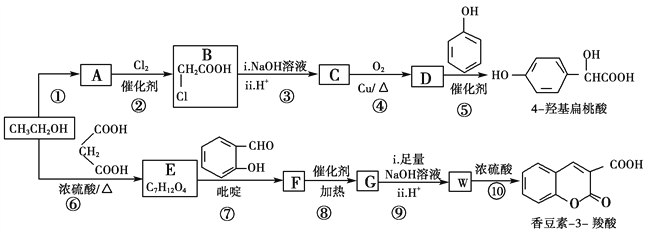
【题目】工业上以乙醇为原料经一系列反应可以得到4羟基扁桃酸和香豆素3羧酸,二者的合成路线如下(部分产物及条件未列出):
已知:
Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
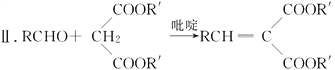
(R,R′,R″表示氢原子、烷基或芳基)
回答下列问题:
(1)反应②属于取代反应,则A中官能团的名称是________
(2)  的名称是________,反应⑤的反应类型为________。
的名称是________,反应⑤的反应类型为________。
(3)反应⑥的化学方程式是________________________________________。
(4)已知G分子中含有2个六元环。下列有关说法正确的是________(填标号)。
a.核磁共振仪可测出E有5种类型的氢原子
b.质谱仪可检测F的最大质荷比的值为236
c. G分子中的碳原子均可以共面
d.化合物W能发生加聚反应得到线型高分子化合物
(5)某芳香化合物Q是4羟基扁桃酸的同分异构体,具有下列特征:①苯环上只有3个取代基;②能发生水解反应和银镜反应;③1 mol Q最多能消耗3 mol NaOH。Q共有________种(不含立体异构)
(6)仔细观察由乙醇合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为_______时,只许3步即可完成合成路线。请写出合成路线_______________
【答案】羧基邻羟基苯甲醛或2-羟基苯甲醛加成反应OHCCOOH+![]()
![]()
![]() cd261:1
cd261:1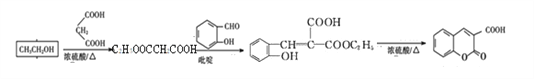
【解析】
本题考查有机物的推断与合成,意在考查考生的分析推理能力。反应②属于取代反应,由反应条件可知A为CH3COOH,ClCH2COOH与氢氧化钠溶液反应、酸化得到C,C为HOCH2COOH,C发生催化氧化得到D,D为OHCCOOH,D与苯酚发生加成反应生成对羟基扁桃酸![]() 。乙醇与丙二酸发生酯化反应生成E,结合E的分子式可知,E的结构简式为C2H5OOCCH2COOC2H5,E与
。乙醇与丙二酸发生酯化反应生成E,结合E的分子式可知,E的结构简式为C2H5OOCCH2COOC2H5,E与![]() 发生信息Ⅱ中反应生成F,F发生系列反应得到香豆素-3-羧酸,由香豆素-3-羧酸的结构简式,可知W为
发生信息Ⅱ中反应生成F,F发生系列反应得到香豆素-3-羧酸,由香豆素-3-羧酸的结构简式,可知W为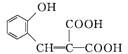 ,则F为
,则F为![]() ,F发生信息Ⅰ中反应生成G,G分子中含有2个六元环,则G为
,F发生信息Ⅰ中反应生成G,G分子中含有2个六元环,则G为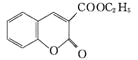 。
。
(1)反应②属于取代反应,由上述分析可知,A的结构简式为CH3COOH,A中官能团的名称是羧基;正确答案:羧基。
(2) 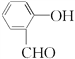 该有机物含有羟基和醛基,属于醛类,名称是邻羟基苯甲醛或2-羟基苯甲醛;结合以上分析可知:有机物 D为OHCCOOH,与苯酚发生加成反应生成
该有机物含有羟基和醛基,属于醛类,名称是邻羟基苯甲醛或2-羟基苯甲醛;结合以上分析可知:有机物 D为OHCCOOH,与苯酚发生加成反应生成![]() ,反应⑤的反应类型为加成反应;正确答案:邻羟基苯甲醛或2-羟基苯甲醛;加成反应。
,反应⑤的反应类型为加成反应;正确答案:邻羟基苯甲醛或2-羟基苯甲醛;加成反应。
(3) 乙醇与丙二酸发生酯化反应生成E,结合E的分子式可知,E的结构简式为C2H5OOCCH2COOC2H5, 反应⑥的化学方程式是OHCCOOH+![]()
![]()
![]() ;正确答案:OHCCOOH+
;正确答案:OHCCOOH+![]()
![]()
![]() 。
。
(4)结合以上分析可知:E为C2H5OOCCH2COOC2H5,F为![]() ,W为
,W为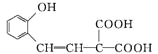 ,G为
,G为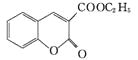 ;a.核磁共振仪可测定E有3种类型的氢原子,a错误;b.F的分子式为C14H16O5,相对分子质量为264,质谱仪可检测最大质荷比的值为264,b错误; c.苯环中的碳共平面,碳碳双键及与之相连的碳有可能共平面,因此G分子中的碳原子均可以共面,c正确;d.化合物W含有碳碳双键,可以发生加聚反应得到线型高分子化合物,d正确;正确选项cd。
;a.核磁共振仪可测定E有3种类型的氢原子,a错误;b.F的分子式为C14H16O5,相对分子质量为264,质谱仪可检测最大质荷比的值为264,b错误; c.苯环中的碳共平面,碳碳双键及与之相连的碳有可能共平面,因此G分子中的碳原子均可以共面,c正确;d.化合物W含有碳碳双键,可以发生加聚反应得到线型高分子化合物,d正确;正确选项cd。
(5) 信息①②说明符合条件的物质中含有苯环、酯基、醛基;结合信息③可知,Q中含甲酸酚酯基、—OH、—CH2OH时,有10种结构;Q中含甲酸酚酯基、—OH、—OCH3时,有10种结构;Q中有2个酚羟基、1个—CH2OOCH时,有6种结构,共26种;正确答案:26。
(6)仔细观察由乙醇合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为1:1,可以用3步即可完成合成路:乙醇与丙二酸反应生成C2H5OOCCH2COOH,该有机物与邻羟基苯甲醛反应生成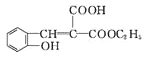 ,根据信息Ⅰ.RCOOR′+R″OH
,根据信息Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH可知,
RCOOR″+R′OH可知,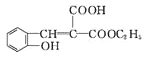 在一定条件下发生生成
在一定条件下发生生成![]() ;流程如下:
;流程如下: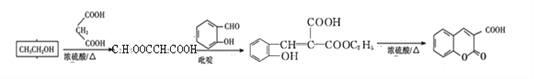 ;正确答案:1:1;
;正确答案:1:1; 。
。


科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
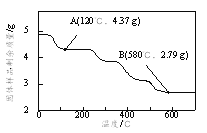
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下左图所示,根据判断出的元素回答问题:

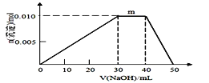
⑴ f在元素周期表的位置是__________。
⑵ 比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________
⑶ 任选上述元素组成一种四原子共价化合物,写出其电子式____________________
⑷ 已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式____________
⑸ 上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如上右图所示:
① R溶液中离子浓度由大到小的顺序是________________
② 写出m点反应的而离子方程式________________________________
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法正确的是
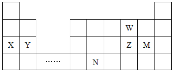
A. 简单氢化物的熔沸点W>Z,是因为W的非金属性强
B. 单核离子的半径:Y2+>X+
C. 溴与元素M同主族,最高价氧化物对应的水化物酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH
NH![]() +OH-
+OH-
B. 用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO![]() (aq)
(aq)![]() SO
SO![]() (aq)+CaCO3(s)
(aq)+CaCO3(s)
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
D. 使用碱性电解质的氢氧燃料电池的正极反应式:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是
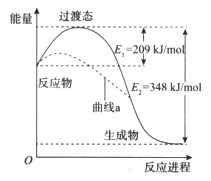
A. 该反应放出了348 kJ的热量
B. 曲线a可能是反应使用了催化剂
C. 断键吸收能量之和大于成键释放能量之和
D. N2O(g)+NO(g)=N2(g)+NO2(g) ![]() =-139kJ/mol
=-139kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如下:
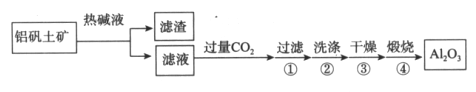
①滤液中通入过量CO2的反应离子方程式是________________。
②煅烧生成氧化铝的化学方程式是______________。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以石墨衬里为阴极,石墨棒为阳极,进行电解。
①电解Al2O3能制备金属铝的原因是__________(填序号)。
a. Al2O3属于电解质
b. Al2O3属于离子化合物
c. Al2O3属于两性氧化物
d. Al2O3在熔融状态时能导电
②Al单质在_________极产生。
③阳极石墨棒需要不断补充,结合电极反应式,简述其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
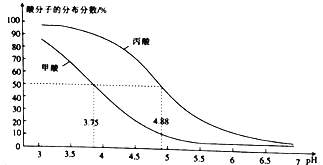
下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com