
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯������ͼ��ʾ�������жϳ���Ԫ�ػش����⣺

�� f��Ԫ�����ڱ���λ����__________��
�� �Ƚ�d��e�������ӵİ뾶��С���û�ѧʽ��ʾ����ͬ��_______��__________�Ƚ�g��h������������Ӧ��ˮ���������ǿ���ǣ�_______��__________
�� ��ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ____________________
�� ��֪1mole�ĵ���������d2��ȼ�գ��ָ������£��ų�255.5kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ____________
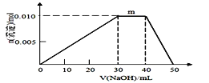
�� ����Ԫ�ؿ������R��zx4f(gd4)2����ʢ��10mL1mol��L-1R��Һ���ձ��еμ�1mol��L-1NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ������ͼ��ʾ��
�� R��Һ������Ũ���ɴ�С��˳����________________
�� д��m�㷴Ӧ�Ķ����ӷ���ʽ________________________________
�� ��R��Һ�ļ�20mL1.2 mol��L-1Ba(OH)2��Һ������в������������ʵ���Ϊ_______mol��
���𰸡��������ڢ�A�� r(O2-) r(Na+) HClO4 H2SO4 ![]() 2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1 c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) NH4+ + OH-��NH3��H2O 0.022
2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1 c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) NH4+ + OH-��NH3��H2O 0.022
��������
x��ԭ��������С��ԭ�Ӱ뾶Ҳ��С������������ϼ�Ϊ+1�ۣ���X��H��e����������ϼ�Ϊ+1�ۣ�ԭ�Ӱ뾶�����e��Na��y��ԭ��������eС���������Ϊ+4�ۣ���y��C��z��ԭ�������Դ���y����������ϼ�Ϊ+5�ۣ���z��N��d��O��fԭ���������ƴ���������ϼ�Ϊ+3�ۣ���f��Al��g��������ϼ�Ϊ-2�ۣ�ԭ��������������g��S��h�����Ϊ-1�ۣ�ԭ��������������h��Cl���ɴ˷��������
��ͼ�еĻ��ϼۡ�ԭ�Ӱ뾶�Ĵ�С��ԭ������������֪��x��HԪ����y��CԪ����z��NԪ����d��OԪ����e��NaԪ����f��AlԪ����g��SԪ����h��ClԪ����
(1)f��AlԪ����ԭ�Ӻ�����3�����Ӳ�������������Ϊ3����Ԫ�����ڱ���λ���ǵ������ڢ�A����
��ˣ�������ȷ�������������ڢ�A����
(2)���Ӳ�ṹ��ͬ���������˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��r(O2-)>r(Na+) ���ǽ�����Խǿ�����������ˮ���������Խǿ����������HClO4 >H2SO4��
��ˣ�������ȷ������r(O2-)>r(Na+)��HClO4 >H2SO4��
(3)x��z�γ���ԭ�ӹ��ۻ�����ΪNH3������ʽΪ![]() ��
��
��ˣ�������ȷ������![]() ��
��
(4)��֪1mol�Ƶĵ���������������ȼ�������ɹ������ƹ������ָ����������ų�255.5kJ���������Է�Ӧ���Ȼ�ѧ����ʽΪ��2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1��
��ˣ�������ȷ������2Na(s)+O2(g) ��Na2O2(s) ��H=-511kJ��mol-1��
��5����1molNH4Al(SO4)2����1molNH4+��1molAl3+��2molSO42-���������������Ũ����ߣ���Ϊ����NH3![]() H2O>Al(OH)3��������Խ��Խˮ������֪Al3+ˮ��̶ȴ���NH4+ˮ��̶ȣ���c(NH4+)��c(Al3+)��Al3+��NH4+ˮ�ⶼ���������ӣ���Һ�����ԣ����������ӵ�Ũ�ȴ���������Ũ�ȣ���Һ������Ũ�ȴ�С˳��Ϊ��c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) ��
H2O>Al(OH)3��������Խ��Խˮ������֪Al3+ˮ��̶ȴ���NH4+ˮ��̶ȣ���c(NH4+)��c(Al3+)��Al3+��NH4+ˮ�ⶼ���������ӣ���Һ�����ԣ����������ӵ�Ũ�ȴ���������Ũ�ȣ���Һ������Ũ�ȴ�С˳��Ϊ��c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-) ��
��m�㴦�����������ʵ������䣬������ӦΪ��笠����Ӻ����������ӷ�Ӧ��һˮ�ϰ��������ӷ���ʽΪNH4+ + OH-��NH3��H2O��
��20mL1.2 mol��L-1Ba(OH)2��Һ����0.048molOH-��0.024molBa2+��10mL1mol��L-1R��Һ�к���0.01molNH4+��0.01molAl3+��0.02molSO42-����0.048molOH-��ȫ��Ӧ��ʱ������0.002mol Al(OH)3δ�ܽ⣬0.02molSO42-�뱵���ӷ�Ӧ����0.02mol���ᱵ���������������������ʵ���Ϊ0.022mol��
��ˣ�������ȷ������c(SO42-)��c(NH4+)��c(Al3+)��c(H+)��c(OH-)��NH4+ + OH-��NH3��H2O�� 0.022��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪���з�Ӧ���ʱ�
��CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ��H1=-870.3kJ/mol
��C(s)+O2(g) =CO2(g) ��H2=-393.5kJ/mol
��2H2(g)+O2(g) =2H2O(l) ��H3=-285.8kJ/mol
�Լ��㷴Ӧ2C(s)+2H2(g)+O2(g) =CH3COOH(l)���ʱ䦤H=_____________kJ/mol��
��2��ʵ���ã�5gҺ̬�״�(CH3OH)�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113��5kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ:_________________________��
��3������ƽ���������̬������N2H4��Ϊȼ�ϡ�Һ̬��������Ϊ��ȼ�����������ṩ����Ӧ���������ɵ�����ɲ������ѭ������õ���Ӧ��������1molˮ��������ʱ�ų�161kJ����������д����Ӧ�����е��Ȼ�ѧ����ʽ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������[(C6H11O7)2Fe2H2O]����Ҫ�Ŀ��������Ӽ�����������Ч���������κá�һ�ֹ�ҵ���Ʊ��������������Ĺ����������£�
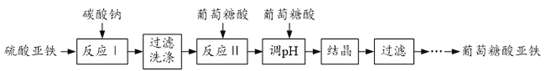
��1����Ӧ���Ļ�ѧ����ʽΪ______��
��2����̼����������ʱ���ڱ��汣��ˮ���ԭ����______��
�ڼ���FeCO3�Ѿ�ϴ�Ӹɾ��IJ���Ϊ______��
��3����Ӧ��������������������ҺpH��5.8����ԭ����______��
��4����������������Һ�ᾧ��ϴ��ʱ��������Ҵ�����Ŀ�ķֱ���______��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���ѧ������
(1) �����еĹ��������л������������������ء�
�����л���������![]() ��Ϊͬϵ�����____(����ĸ)��
��Ϊͬϵ�����____(����ĸ)��
a. ![]() b.
b. ![]() c.
c. ![]()
�����л�������,��������ʹ���Ը��������Һ��ɫ����____(����ĸ)��
a. CH3CH3 b. HC��CH c. CH3COOH
�����л�������,�ܷ���������Ӧ����____(����ĸ)��
a. CH3CH2Cl b. CH3CHO c. CH3CH2OH
(2) ������X(![]() )��һ�ֺϳ�Һ�����ϵĻ���ԭ�ϡ�
)��һ�ֺϳ�Һ�����ϵĻ���ԭ�ϡ�
��1 mol X��һ���������������____mol H2�����ӳɷ�Ӧ��
��X������������ˮ�������![]() ��________(�ýṹ��ʽ��ʾ)��
��________(�ýṹ��ʽ��ʾ)��
��![]() �����������____��̼ԭ�ӹ�ƽ�档
�����������____��̼ԭ�ӹ�ƽ�档
(3) ������D��һ��ҽҩ�м���,��ͨ�����з����ϳɡ�
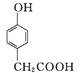 A
A![]()
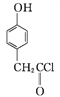 B����
B����![]()
 C������ ����
C������ ����![]()
 D
D
��A��B�ķ�Ӧ����Ϊ____��
��D�����������____��____(������)��
��C��D�ķ�Ӧ����HCl����,��M�Ľṹ��ʽΪ_______��
��E��A��һ��ͬ���칹��,E���ӵĺ˴Ź���������4�����շ�,�ܷ���������Ӧ,����FeCl3��Һ������ɫ��Ӧ��E�Ľṹ��ʽΪ___________(��дһ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪W��X��Y��ZΪ������Ԫ�أ�W��Zͬ���壬X��Y��Zͬ���ڣ�W����̬�⻯����ȶ��Դ���Z����̬�⻯���ȶ��ԣ�X��YΪ����Ԫ�أ�X�������ӵ�������С��Y�������ӵ������ԣ�����˵����ȷ����
A. X��Y��Z��W��ԭ�Ӱ뾶���μ�С
B. W��X�γɵĻ�������ֻ�����Ӽ�
C. W����̬�⻯��ķе�һ������Z����̬�⻯��ķе�
D. ��W��Y��ԭ���������5��������γɻ�����Ļ�ѧʽһ��ΪY2W3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�����������ȡ��ơ�ͭ��Ԫ�صĻ�����㷺��������Ȼ�磬�ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ͼ��________________________����̬ͭԭ�Ӻ������ռ�еĿռ��˶�״̬��____________��
��2��̼������������Ԫ���е�һ������������____________ (��Ԫ�ط���)CO32-��̼ԭ�ӵ��ӻ��������Ϊ____________��
��3����ͬ�����£�ˮ�ķе����Һ����ԭ����________________________��
��4��ͭ��CN�����γ��������[Cu(CN��)4]2-��д��һ����CN����Ϊ�ȵ�����ķ��ӵĻ�ѧʽ____________��1 mol[ Cu(CN��)4]2-�к���____________mol����������[Cu(CN��)4]2-�ж���CN����ΪCl����ֻ��һ�ֽṹ����[Cu(CN��)4]2-��4����ԭ�������ռ�λ�ù�ϵΪ_________��
��5���Ȼ��Ƶľ�����ͼ��ʾ���������������������������ܶѻ����У�������Ƕ����������֮��Ŀ�϶�С�һ����������Χ���������������������ĿΪ__________������֪���뾶r(Cl��)=apm��r(Na+)=bpm��Ħ������M(NaCI)=cg��mol-1���Ȼ��ƾ�����ܶ�Ϊ_________g��cm-3

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���˵����ȷ���ǣ�������
A. HCl��NaOH��Ӧ���к��ȡ�H=��57.3 kJ/mol����H2SO4��Ba(OH)2��Ӧ���к��ȡ�H=2��(��57.3) kJ/mol
B. ��֪C2H5OH(l)��ȼ������1366.8 kJ/mol����C2H5OH(l)+3O2(g) �T 2CO2(g)+3H2O(g) ��Ӧ�ġ�H=��1366.8 kJ/mol
C. һ��������2SO2(g)+O2(g)![]() 2SO3(g) ��H1<0��2SO2(g)+O2(g)
2SO3(g) ��H1<0��2SO2(g)+O2(g)![]() 2SO3(l) ��H2<0�����H1����H2
2SO3(l) ��H2<0�����H1����H2
D. ��һ���¶Ⱥ�ѹǿ�£���0.5mol N2��1.5 mol H2�����ܱ������г�ַ�Ӧ����NH3��g�����ų�����19.3 kJ�������Ȼ�ѧ����ʽΪN2(g)+3H2(g)![]() 2NH3(g) ��H=��38.6kJ/mol
2NH3(g) ��H=��38.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
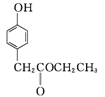
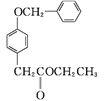
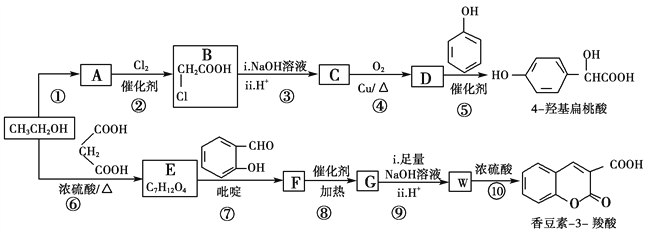
����Ŀ����ҵ�����Ҵ�Ϊԭ�Ͼ�һϵ�з�Ӧ���Եõ�4�ǻ���������㶹��3���ᣬ���ߵĺϳ�·������(���ֲ��P����δ�г�)��
��֪��
��.RCOOR�䣫R��OH![]() RCOOR�士R��OH
RCOOR�士R��OH
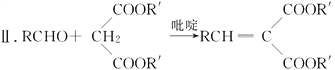
(R��R�䣬R����ʾ��ԭ�ӡ������)
�ش��������⣺
��1����Ӧ������ȡ����Ӧ����A�й����ŵ�������________
��2��  ��������________����Ӧ�ݵķ�Ӧ����Ϊ________��
��������________����Ӧ�ݵķ�Ӧ����Ϊ________��
��3����Ӧ�Ļ�ѧ����ʽ��________________________________________��
��4����֪G�����к���2����Ԫ���������й�˵����ȷ����________(����)��
a���˴Ź����ǿɲ��E��5�����͵���ԭ��
b�������ǿɼ��F������ʺɱȵ�ֵΪ236
c�� G�����е�̼ԭ�Ӿ����Թ���
d��������W�ܷ����Ӿ۷�Ӧ�õ����߷��ӻ�����
��5��ij���㻯����Q��4�ǻ��������ͬ���칹�壬���������������ٱ�����ֻ��3��ȡ���������ܷ���ˮ�ⷴӦ��������Ӧ����1 mol Q���������3 mol NaOH��Q����________��(���������칹)
��6����ϸ�۲����Ҵ��ϳ��㶹��-3-����Ĺ��̣���������Ϣ�����Ҵ������������ʵ����ı�Ϊ_______ʱ��ֻ��3��������ɺϳ�·�ߡ���д���ϳ�·��_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������������ˮ��pH��5.0~6.0֮�䣬ͨ���������Fe(OH)3���壬Fe(OH)3��������������ã�������ˮ�е������ʹ�������������ˮ�����ã���ԭ����ͼ��ʾ������˵����ȷ����

A. ʯī�缫�Ϸ���������Ӧ B. ͨ����ĵ缫��Ӧʽ��CH4+4CO32--8e-=5CO2+2H2O
C. ͨ�����ĵ缫��ӦʽΪO2+4e-=2O2- D. ����ȼ�ϵ����CO32-�����һ���ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com