
【题目】对于3Br2+6NaOH![]() 5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
5NaBr+NaBrO3+3H2O的反应,下列说法中不正确的是( )
A. Br 2既是氧化剂,又是还原剂
B. 被氧化的溴原子与被还原的溴原子质量比是1:5
C. NaBr是氧化产物,NaBrO3是还原产物
D. 转移1mol电子时,消耗NaOH 1.2mol
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
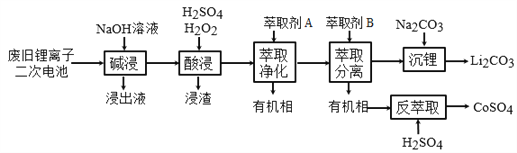
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
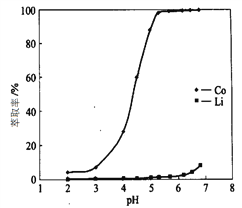
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
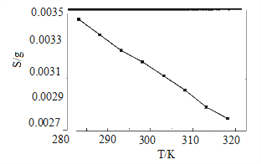
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。现有下列两种制备ClO2的方法:
(1)方法一:可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因____________________________________。
(2)方法二:氯化钠电解法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,二氧化氯发生器中生成ClO2的化学方程式为_________________________________。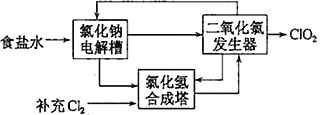
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)当有34gNH3参加反应时,被氧化的物质的质量为_____ g,生成的还原产物的质量为_______g。
(2)在反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,用氧化还原反应的知识____是氧化剂,_____是还原剂,用“双线桥法”表示反应中电子转移的方向和数目:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰和高分子树脂M的合成路线如图所示:
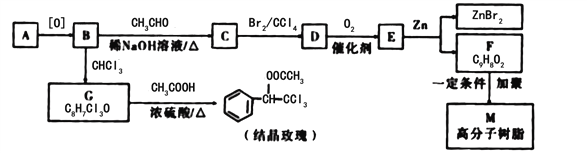
已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的密度为46
②![]()
③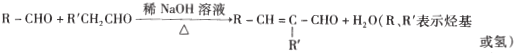
④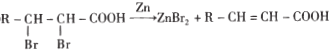
(1)C中含氧官能团的名称为______,E的结构简式为_____。
(2)写出由G生成结晶玫瑰的化学方程式________________________________。
(3)在上述流程中“C→D”在M的合成过程中的作用是___________________________
(4)己知G在一定条件下水解生成![]() ,写出H满足下列条件的同分异构体的结构简式______________________________
,写出H满足下列条件的同分异构体的结构简式______________________________
a与氯化铁溶液发生显色反应
b苯环上的一氯取代物只有一种
c与足量的氢氧化钠溶液反应,![]() 可消耗
可消耗![]() NaOH
NaOH
(5)E的同分异构体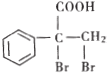 是一种重要的药物中间体,其合成路线与E相似,请以
是一种重要的药物中间体,其合成路线与E相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_______________.
为原料设计它的合成路线(其他所需原料自选)_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下:
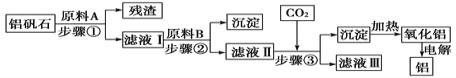
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,正确的是________。
A.铝矾石中含有两种类型氧化物
B.铝矾石与河沙含有完全相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中涉及置换反应
(2)加入原料A时发生反应的离子方程式有_____________。
(3)滤液Ⅱ中所含溶质有__________;步骤③反应的离子方程式为___________。
(4)若步骤③中用氨气代替CO2,步骤③生成沉淀的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。
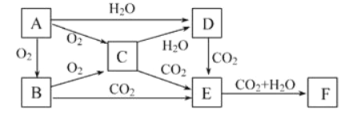
(1)写出下列物质的名称:B____________、E_____。
(2)写出E→F的离子方程式________________________。
F(固体)→E的化学方程式_____________。
(3)写出C与二氧化碳反应的化学方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为常见的金属单质,根据下图所示的关系:
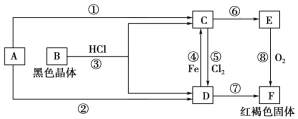
下列叙述中不正确的是
A. A为Fe,B为Fe3O4
B. C→D溶液的颜色变化:由浅绿色到黄色
C. ④的离子方程式:Fe+Fe3+===2Fe2+
D. ⑧的化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有1mL 0.01 mol/L | 证明在相同温度下的 Ksp(AgCl)>Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com