
ΓΨΧβΡΩΓΩΕΰ―θΜ·¬»(ClO2) «“Μ÷÷‘ΎΥ°¥ΠάμΒ»ΖΫΟφ”–ΙψΖΚ”Π”ΟΒΡΗΏ–ßΑ≤»ΪœϊΕΨΦΝΘ§Εχ«“”κCl2œύ±»≤ΜΜα≤ζ…ζΕ‘»ΥΧε”–«±‘ΎΈΘΚΠΒΡ”–Μ欻¥ζΈοΓΘœ÷”–œ¬Ν–ΝΫ÷÷÷Τ±ΗClO2ΒΡΖΫΖ®:
Θ®1Θ©ΖΫΖ®“ΜΘΚΩ…”Ο―«¬»ΥαΡΤΚΆœΓ―ΈΥαΈΣ‘≠Νœ÷Τ±ΗΘ§Ζ¥”Π‘≠άμΈΣ5NaClO2+4HCl=5NaCl+4ClO2Γϋ+2H2OΓΘ
ΔΌΗΟΖ¥”Π÷–―θΜ·ΦΝΚΆΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±» «_______________________ΓΘ
ΔΎ―–ΨΩ±μΟςΘΚ»τΖ¥”ΠΩΣ Φ ±―ΈΥα≈®Ε»Ϋœ¥σΘ§‘ρΤχΧε≤ζΈο÷–”–Cl2Θ§”ΟάκΉ”ΖΫ≥Χ ΫΫβ Ά≤ζ…ζCl2ΒΡ‘≠“ρ____________________________________ΓΘ
Θ®2Θ©ΖΫΖ®ΕΰΘΚ¬»Μ·ΡΤΒγΫβΖ®ΓΘ
ΔΌ”Ο”ΎΒγΫβΒΡ ≥―ΈΥ°–ηœ»≥ΐ»ΞΤδ÷–ΒΡCa2+ΓΔMg2+ΓΔSO42-Β»‘”÷ ΓΘΡ≥¥Έ≥ΐ‘”≤ΌΉς ±Θ§Άυ¥÷―ΈΥ°÷–œ»Φ”»κΙΐΝΩΒΡ________Θ®ΧνΜ·―ß ΫΘ©Θ§÷Ν≥ΝΒμ≤Μ‘Ό≤ζ…ζΚσΘ§‘ΌΦ”»κΙΐΝΩΒΡNa2CO3ΚΆNaOHΘ§≥δΖ÷Ζ¥”ΠΚσΫΪ≥ΝΒμ“Μ≤Δ¬Υ»ΞΓΘ
ΔΎΗΟΖ®ΙΛ“’‘≠άμ Ψ“βΆΦ»γΆΦΥυ ΨΓΘΤδΙΐ≥Χ «ΫΪ ≥―ΈΥ°‘ΎΧΊΕ®ΧθΦΰœ¬ΒγΫβΒΟΒΫΒΡ¬»ΥαΡΤΘ®NaClO3Θ©”κ―ΈΥαΖ¥”Π…ζ≥…ClO2Θ§Εΰ―θΜ·¬»ΖΔ…ζΤς÷–…ζ≥…ClO2ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_________________________________ΓΘ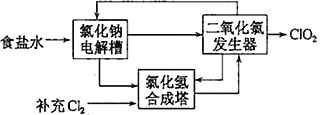
ΓΨ¥πΑΗΓΩ 1:4 4H++ClO2-+3Cl-=2Cl2Γϋ+2H2O BaCl2 2NaClO3+4HCl=2NaCl+Cl2Γϋ+2ClO2Γϋ+2H2O
ΓΨΫβΈωΓΩΘ®1Θ©ΔΌΗυΨίΓΑ÷ΜΩΩ¬ΘΘ§≤ΜΫΜ≤φΓ±Θ§”ΟΥΪœΏ«≈Ζ®Ζ÷ΈωΗΟ―θΜ·ΜΙ‘≠Ζ¥”ΠΓΘ
ΔΎ≤ζ…ζCl2ΥΒΟςNaClO2ΫΪ≈®Ε»Ϋœ¥σΒΡ―ΈΥα―θΜ·Θ§ClO2-±ΜΜΙ‘≠≥…Cl2Θ§HCl÷–-1ΦέΒΡCl±Μ―θΜ·≥…Cl2Θ§ΗυΨίΒΟ ßΒγΉ” ΊΚψΓΔ‘≠Ή” ΊΚψΚΆΒγΚ… ΊΚψ ι–¥άκΉ”ΖΫ≥Χ ΫΓΘ
Θ®2Θ©ΔΌ≥ΐ»ΞCa2+ΓΔMg2+ΓΔSO42-“ά¥Έ―Γ”ΟNa2CO3ΓΔNaOHΓΔBaCl2Θ§”…”ΎΥυΦ”≥ΐ‘” ‘ΦΝΙΐΝΩΘ§BaCl2œ»”ΎNa2CO3Φ”»κΓΘ
ΔΎ‘ΎΧΊΕ®ΧθΦΰœ¬ΒγΫβNaCl»ή“ΚΒΟΒΫNaClO3ΚΆH2Θ§Κœ≥…Υΰ÷–ΈΣH2”κCl2Κœ≥…HClΘ§NaClO3”κHClΖ¥”Π÷Τ±ΗClO2Θ§ΗυΨίΆΦ ΨΕΰ―θΜ·¬»ΖΔ…ζΤς÷–”–1÷÷…ζ≥…ΈοΦ”»κΒγΫβ≤έ÷–―≠ΜΖ Ι”ΟΘ§1÷÷…ζ≥…ΈοΫχ»κΚœ≥…Υΰ÷–Κœ≥…HClΘ§‘ρNaClO3±ΜΜΙ‘≠≥…ClO2Θ§HCl±Μ―θΜ·≥…Cl2Θ§NaClO3”κHClΖ¥”Π…ζ≥…ClO2ΓΔCl2ΓΔNaClΚΆH2OΓΘ
Θ®1Θ©ΔΌΗυΨίΓΑ÷ΜΩΩ¬ΘΘ§≤ΜΫΜ≤φΓ±Θ§Ζ¥”Π5NaClO2+4HCl=5NaCl+4ClO2Γϋ+2H2O”ΟΥΪœΏ«≈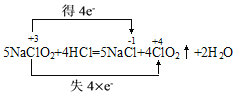 Θ§‘ΎΖ¥”Π÷–NaClO2Φ» «―θΜ·ΦΝ”÷ «ΜΙ‘≠ΦΝΘ§ΗΟΖ¥”Π÷–―θΜ·ΦΝΚΆΜΙ‘≠ΦΝΈο÷ ΒΡΝΩ÷°±»ΈΣ1:4ΓΘ
Θ§‘ΎΖ¥”Π÷–NaClO2Φ» «―θΜ·ΦΝ”÷ «ΜΙ‘≠ΦΝΘ§ΗΟΖ¥”Π÷–―θΜ·ΦΝΚΆΜΙ‘≠ΦΝΈο÷ ΒΡΝΩ÷°±»ΈΣ1:4ΓΘ
ΔΎ≤ζ…ζCl2ΥΒΟςNaClO2ΫΪ≈®Ε»Ϋœ¥σΒΡ―ΈΥα―θΜ·Θ§ClO2-±ΜΜΙ‘≠≥…Cl2Θ§HCl÷–-1ΦέΒΡCl±Μ―θΜ·≥…Cl2Θ§ΗυΨίΒΟ ßΒγΉ” ΊΚψΓΔ‘≠Ή” ΊΚψΚΆΒγΚ… ΊΚψΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣClO2-+3Cl-+4H+=2Cl2Γϋ+2H2OΓΘ
Θ®2Θ©ΔΌ≥ΐ»ΞCa2+ΓΔMg2+ΓΔSO42-“ά¥Έ―Γ”ΟNa2CO3ΓΔNaOHΓΔBaCl2Θ§”…”ΎΥυΦ”≥ΐ‘” ‘ΦΝΙΐΝΩΘ§BaCl2œ»”ΎNa2CO3Φ”»κΓΘ≥ΐ‘”ΒΡ≤ΌΉς «ΘΚΆυ¥÷―ΈΥ°÷–œ»Φ”»κΙΐΝΩΒΡBaCl2Θ§÷Ν≥ΝΒμ≤Μ‘Ό≤ζ…ζΚσΘ§‘ΌΦ”»κΙΐΝΩΒΡNa2CO3ΚΆNaOHΘ§≥δΖ÷Ζ¥”ΠΚσΫΪ≥ΝΒμ“Μ≤Δ¬Υ»ΞΓΘ
ΔΎ‘ΎΧΊΕ®ΧθΦΰœ¬ΒγΫβNaCl»ή“ΚΒΟΒΫNaClO3ΚΆH2Θ§Κœ≥…Υΰ÷–ΈΣH2”κCl2Κœ≥…HClΘ§NaClO3”κHClΖ¥”Π÷Τ±ΗClO2Θ§ΗυΨίΆΦ ΨΕΰ―θΜ·¬»ΖΔ…ζΤς÷–”–1÷÷…ζ≥…ΈοΦ”»κΒγΫβ≤έ÷–―≠ΜΖ Ι”ΟΘ§1÷÷…ζ≥…ΈοΫχ»κΚœ≥…Υΰ÷–Κœ≥…HClΘ§‘ρNaClO3±ΜΜΙ‘≠≥…ClO2Θ§HCl±Μ―θΜ·≥…Cl2ΘΜNaClO3”κHClΖ¥”Π…ζ≥…ClO2ΓΔCl2ΓΔNaClΚΆH2OΘ§ΗυΨίΒΟ ßΒγΉ” ΊΚψΚΆ‘≠Ή” ΊΚψΘ§Εΰ―θΜ·¬»ΖΔ…ζΤς÷–…ζ≥…ClO2ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2NaClO3+4HCl=2NaCl+Cl2Γϋ+2ClO2Γϋ+2H2OΓΘ


 –¬ΜνΝΠΉήΕ·‘± νœΒΝ–¥πΑΗ
–¬ΜνΝΠΉήΕ·‘± νœΒΝ–¥πΑΗ Νζ»ΥΆΦ ιΩλά÷ΦΌΤΎ νΦΌΉς“Β÷Θ÷ί¥σ―ß≥ωΑφ…γœΒΝ–¥πΑΗ
Νζ»ΥΆΦ ιΩλά÷ΦΌΤΎ νΦΌΉς“Β÷Θ÷ί¥σ―ß≥ωΑφ…γœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬ΆΦ « Β―ι “ΒΡΝρΥα ‘ΦΝ±ξ«©…œΒΡ≤ΩΖ÷ΡΎ»ίΓΘΨί¥ΥΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
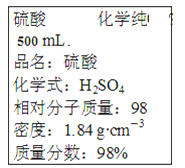
A. ΗΟΝρΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ9.2molΓΛLΘ≠1
B. 1mol Fe”κΉψΝΩΒΡœΓΝρΥαΖ¥”ΠΘ§±ξΉΦΉ¥Ωωœ¬≤ζ…ζ44.8LΤχΧε
C. »τ Β―ι “–η“Σ4.6 mol/LΒΡœΓΝρΥα500mLΘ§≈δ÷ΤœΓΝρΥα ±‘ρ”ΠΝΩ»ΓΗΟΝρΥα125.0mL
D. ΗΟΝρΥα”κΒ»ΧεΜΐΒΡΥ°ΜλΚœΚσΘ§ΥυΒΟ»ή“ΚΒΡ÷ ΝΩΖ÷ ΐΒ»”Ύ49%
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®ΧβΈΡΘ©œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. Α¥œΒΆ≥ΟϋΟϊΖ®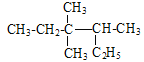 ΒΡΟϊ≥ΤΈΣ3Θ§3-ΕΰΦΉΜυ-2-““ΜυΈλΆι
ΒΡΟϊ≥ΤΈΣ3Θ§3-ΕΰΦΉΜυ-2-““ΜυΈλΆι
B. ‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§““ΥαΓΔΑ±Μυ““ΥαΓΔΒΑΑΉ÷ ΨυΡή”κNaOHΖΔ…ζΖ¥”Π
C. Ζ÷Ή” ΫΈΣC5H12OΒΡ¥ΦΙ≤”–8 ÷÷Θ§Τδ÷–Ρή¥ΏΜ·―θΜ·≥…»©ΒΡΆ§Ζ÷“λΙΙΧε”–3 ÷÷
D. Ψέ““œ©( PE)ΚΆΨέ¬»““œ©( PVC)ΒΡΒΞΧεΕΦ «≤Μ±ΞΚΆΧΰΘ§’β–©ΒΞΧεΨυΡή ΙδεΥ°Ά …Ϊ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σ‘Ύ“ΜΕ®ΧθΦΰœ¬Θ§Ζ¥”Π X(g)+3Y(g![]() 2Z(g) ΓςH=-a kJ/mol(a>0 )Θ§Ρ≥ Β―ι–ΓΉι≤βΒΟXΒΡΉΣΜ·¬ (ΠΝ)‘Ύ≤ΜΆ§Έ¬Ε»”κ―Ι«ΩΘ®P)œ¬ ΒΡ Β―ι ΐΨίΘ§»ΐ’Ώ÷°ΦδΙΊœΒ»γœ¬ΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
2Z(g) ΓςH=-a kJ/mol(a>0 )Θ§Ρ≥ Β―ι–ΓΉι≤βΒΟXΒΡΉΣΜ·¬ (ΠΝ)‘Ύ≤ΜΆ§Έ¬Ε»”κ―Ι«ΩΘ®P)œ¬ ΒΡ Β―ι ΐΨίΘ§»ΐ’Ώ÷°ΦδΙΊœΒ»γœ¬ΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «

A. ΆΦ÷–aΓΔbΝΫΒψΕ‘”ΠΒΡΤΫΚβ≥Θ ΐœύΒ»
B. …œ ωΖ¥”Π‘Ύ¥οΒΫΤΫΚβΚσΘ§Υθ–ΓΧεΜΐΘ§YΒΡΉΣΜ·¬ ΧαΗΏ
C. …ΐΗΏΈ¬Ε»Θ§’ΐΓΔΡφΖ¥”ΠΥΌ¬ ‘ω¥σΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·
D. ΫΪ2.0molXΓΔ6.0molYΘ§÷Ο”ΎΟή±’»ίΤς÷–ΖΔ…ζΖ¥”ΠΘ§Ζ≈≥ωΒΡ»»ΝΩΈΣ2akJ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΝρΥα―«Χζοß[(NH4)2SO4ΓΛFeSO4ΓΛ6H2O]ΥΉ≥ΤΡΣΕϊ―ΈΘ§ΤδΡΠΕϊ÷ ΝΩΈΣ392 g/molΘ§Ω…»ή”ΎΥ°Θ§‘Ύ100Γφ~ 110 Γφ ±Ζ÷ΫβΓΘΈΣΧΫΨΩΤδΜ·―ßΉι≥…Θ§ΦΉ““ΝΫΆ§―ß…ηΦΤΝΥ»γœ¬ Β―ιΓΘ
Δώ.ΧΫΨΩΡΣΕϊ―ΈΨßΧεΦ”»» ±ΒΡΖ÷Ϋβ≤ζΈοΓΘ
Θ®1Θ©ΦΉΆ§―ß…ηΦΤ»γœ¬ΆΦΥυ ΨΒΡΉΑ÷ΟΫχ–– Β―ιΘ§ΉΑ÷ΟC÷–Ω…Ιέ≤λΒΫΒΡœ÷œσ «»ή“Κ±δΚλΘ§”…¥ΥΩ…÷ΣΖ÷Ϋβ≤ζΈο÷–”–_____________ΓΘ

Θ®2Θ©““Ά§―ß»œΈΣΡΣΕϊ―ΈΨßΧεΖ÷ΫβΒΡ≤ζΈο÷–ΜΙΚ§”–SO3(g)ΓΔSO2(g)ΦΑN2(g)ΓΘΈΣ―ι÷Λ≤ζΈοΒΡ¥φ‘ΎΘ§”Οœ¬Ν–ΉΑ÷ΟΫχ–– Β―ιΘΚ

ΔΌ““ΉιΆ§―ßΒΡ Β―ι÷–Θ§ΉΑ÷Ο“ά¥ΈΝ§Ϋ”ΒΡΚœάμΥ≥–ρΈΣAΓζHΓζ__________________________ΓζG
ΔΎ÷ΛΟςΚ§”–SO3ΒΡ Β―ιœ÷œσ «_______________ΓΘ
II.ΈΣ≤βΝρΥα―«ΧζοߥΩΕ»,≥Τ»Γm g ΡΣΕϊ―Έ―υΤΖΘ§≈δ≥…500 mL»ή“ΚΓΘΦΉΓΔ““ΝΫΆ§―ß…ηΦΤΝΥ»γœ¬ΝΫΗω Β―ιΖΫΑΗΓΘ
ΦΉΖΫΑΗΘΚ»Γ25.00mLΝρΥα―«Χζοß»ή“Κ”Ο0.1000molL-1ΒΡΥα–‘K2Cr2O7»ή“ΚΖ÷»ΐ¥ΈΫχ––ΒΈΕ®ΓΘ
““ΖΫΑΗΘΚ(Ά®ΙΐNH4+≤βΕ®)…ηΦΤΉΑ÷Ο»γœ¬ΆΦΥυ ΨΓΘ»Γ25.00 mL―υΤΖ»ή“ΚΫχ––ΗΟ Β―ιΓΘ
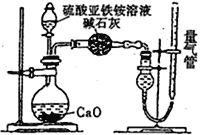
Θ®1Θ©ΒΈΕ®Ιΐ≥Χ÷–Θ§Υα–‘K2Cr2O7»ή“Κ”ΠΉΑ‘Ύ_____________ΒΈΕ®Ιή÷–ΓΘΦΉΖΫΑΗ÷–ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_________________________________ΓΘ
Θ®2Θ©““ΖΫΑΗ÷–ΝΩΤχΙή÷–ΉνΦ― ‘ΦΝ «______Θ®ΧνΉ÷ΡΗΘ©ΓΘ
a.Υ° b.±ΞΚΆNaHCO3»ή“Κ c.CC14
Θ®3Θ©““ΖΫΑΗ÷– ’Φ·ΆξΤχΧε≤ΔΜ÷Η¥÷Ν “Έ¬Θ§ΕΝ ΐ«Α”ΠΫχ––ΒΡ≤ΌΉς «______________________________ΓΘ
Θ®4Θ©»τ≤βΒΟNH3(“―’έΥψΈΣ±ξΉΦΉ¥Ωωœ¬)ΈΣVLΘ§‘ρΝρΥα―«ΧζοߥΩΕ»ΈΣ___________ΓΘ(”ΟΚ§VΓΔmΒΡ ΫΉ”±μ Ψ)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣΝΥ≤βΕ®Ρ≥Ά≠“χΚœΫπΒΡΉι≥…Θ§ΫΪ30.0gΚœΫπ»ή”Ύ80.0mL 13.5molΓΛL1ΒΡ≈®HNO3÷–ΓΘ¥ΐΚœΫπΆξ»Ϊ»ήΫβΚσΘ§ ’Φ·ΒΫΤχΧε6.72L(±ξΉΦΉ¥Ωωœ¬)≤Δ≤βΒΟH+≈®Ε»ΈΣ1molΓΛL1ΓΘΦΌ…ηΖ¥”ΠΚσ»ή“ΚΒΡΧεΜΐΈΣ80.0mLΘ§ ‘ΦΤΥψΘΚ
(1)±ΜΜΙ‘≠ΒΡœθΥαΒΡΈο÷ ΒΡΝΩ___________ΘΜ
(2)ΚœΫπ÷–“χΒΡ÷ ΝΩΖ÷ ΐ___________ΓΘ
(3)»ΖΕ®6.72LΤχΧε÷–Ης≥…Ζ÷ΒΡΈο÷ ΒΡΝΩ___________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§œρ20mL 0.5molΓΛL-1ΒΡCH3COOH»ή“Κ÷–÷πΒΈΒΈΦ”0Θ°5molΓΛL-1ΒΡNaOH»ή“ΚΘ§ΒΈΕ®«ζœΏ»γΆΦΓΘœύΙΊΖ÷Έω’ΐ»ΖΒΡ «
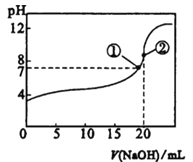
A. ΒΈΦ”÷ΝΔΌ ±Θ§c(Na+)=c(CH3COO-)Θ§ΥαΦν«ΓΚΟΆξ»ΪΖ¥”Π
B. ΒΈΦ”÷ΝΔΎ ±Θ§c(OH-)ΓΣc(H+) =c(CH3COOH)
C. ΒΈΕ®÷–Θ§c(CH3COO-)Θ·c(H+)÷πΫΞΦθ–Γ
D. ΒΈΕ®÷–,c(CH3COOH)”κc(CH3COO-)÷°ΚΆ±Θ≥÷≤Μ±δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕ‘”Ύ3Br2ΘΪ6NaOH![]() 5NaBrΘΪNaBrO3ΘΪ3H2OΒΡΖ¥”ΠΘ§œ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «Θ® Θ©
5NaBrΘΪNaBrO3ΘΪ3H2OΒΡΖ¥”ΠΘ§œ¬Ν–ΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A. Br 2Φ» «―θΜ·ΦΝΘ§”÷ «ΜΙ‘≠ΦΝ
B. ±Μ―θΜ·ΒΡδε‘≠Ή””κ±ΜΜΙ‘≠ΒΡδε‘≠Ή”÷ ΝΩ±» «1:5
C. NaBr «―θΜ·≤ζΈοΘ§NaBrO3 «ΜΙ‘≠≤ζΈο
D. ΉΣ“Τ1molΒγΉ” ±Θ§œϊΚΡNaOH 1.2mol
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σ‘Ύ25Γφ,101kPaœ¬,1gC8H28(–ΝΆι)»Φ…’…ζ≥…Εΰ―θΜ·ΧΦΚΆ“ΚΧ§Υ° ±Ζ≈≥ω48.4kJ»»ΝΩ.±μ Ψ…œ ωΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ Ϋ’ΐ»ΖΒΡ «
A. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ΓςH=-5517.6 KJΓΛmolΓΣ1
O2(g)===8CO2(g)+9H2O(l) ΓςH=-5517.6 KJΓΛmolΓΣ1
B. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ΓςH=-48.4 KJΓΛmolΓΣ1
O2(g)===8CO2(g)+9H2O(l) ΓςH=-48.4 KJΓΛmolΓΣ1
C. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ΓςH=+5517.6 KJΓΛmolΓΣ1
O2(g)===8CO2(g)+9H2O(l) ΓςH=+5517.6 KJΓΛmolΓΣ1
D. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) ΓςH=+48.4 KJΓΛmolΓΣ1
O2(g)===8CO2(g)+9H2O(l) ΓςH=+48.4 KJΓΛmolΓΣ1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com