
����Ŀ����֪���������[(NH4)2SO4��FeSO4��6H2O]�׳�Ī���Σ���Ħ������Ϊ392 g/mol��������ˮ����100��~ 110 ��ʱ�ֽ⡣Ϊ̽���仯ѧ��ɣ�������ͬѧ���������ʵ�顣
��.̽��Ī���ξ������ʱ�ķֽ���
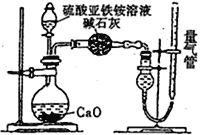
��1����ͬѧ�������ͼ��ʾ��װ�ý���ʵ�飬װ��C�пɹ۲쵽����������Һ��죬�ɴ˿�֪�ֽ��������_____________��

��2����ͬѧ��ΪĪ���ξ���ֽ�IJ����л�����SO3(g)��SO2(g)��N2(g)��Ϊ��֤����Ĵ��ڣ�������װ�ý���ʵ�飺

������ͬѧ��ʵ���У�װ���������ӵĺ���˳��ΪA��H��__________________________��G
��֤������SO3��ʵ��������_______________��
II.Ϊ����������林���,��ȡm g Ī������Ʒ�����500 mL��Һ���ס�����ͬѧ�������������ʵ�鷽����
������ȡ25.00mL�����������Һ��0.1000molL-1������K2Cr2O7��Һ�����ν��еζ���
�ҷ�����(ͨ��NH4+�ⶨ)���װ������ͼ��ʾ��ȡ25.00 mL��Ʒ��Һ���и�ʵ�顣
��1���ζ������У�����K2Cr2O7��ҺӦװ��_____________�ζ����С������е����ӷ���ʽΪ_________________________________��
��2���ҷ�����������������Լ���______������ĸ����
a.ˮ b.����NaHCO3��Һ c.CC14
��3���ҷ������ռ������岢�ָ������£�����ǰӦ���еIJ�����______________________________��
��4�������NH3(������Ϊ��״����)ΪVL������������林���Ϊ___________��(�ú�V��m��ʽ�ӱ�ʾ)
���𰸡� NH3 F��D��E F�г��ְ�ɫ���� ��ʽ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O c �����ƶ������ܣ��ζ��ܣ���ʹ��������Һ����ƽ 175 V/m��100%��![]() ��100%
��100%
��������I.��1������Ī���ε���ɣ�Ī�������ȷֽ������ʹ��̪��Һ��������ΪNH3��
��2����ͬѧ��ΪĪ���ξ���ֽ�IJ����л�����SO3��g����SO2��g����N2��g������BaCl2����������Ļ��Һ����SO3��g������Ʒ����Һ����SO2��g����N2������ˮ����ˮ���ռ�������SO3�ܱ�ˮ��Һ���գ������ȼ���SO3��g�����ټ���SO2��g������NaOH��Һ��ȥSO2���������ˮ���ռ�N2��װ�õĺ�������˳��ΪA��H��F��D��E��G��
II.��1������K2Cr2O7��Һ����ǿ�����ԣ�Ӧװ����ʽ�ζ����С�Cr2O72-��Fe2+������Fe3+����������ԭ��Cr3+�����ݵ�ʧ�����غ㡢ԭ���غ�͵���غ���ƽ��
��2�������ҷ�����װ�ã������������Һ��CaO��Ӧ����NH3���ü�ʯ�ҳ�ȥNH3�е�H2O��g��������������ȡNH3�������ˮ�ͱ���NaHCO3��Һ������NH3��NH3������CCl4��������������Լ�ΪCCl4��
��3�����������������ж���ʵ��ʱ������Ҫ�����¶Ⱥ�ѹǿ������ʵ�����Ҫ�ָ������£�ʹ���������ѹǿ���ڴ���ѹ��
��4������N�غ������������淋���������һ����������������
I.��1��װ��B�еļ�ʯ�����շֽ�������������壬װ��C�з�̪��Һ��죬����Ī���ε���ɣ���Ī�������ȵķֽ��������NH3��
��2����ͬѧ��ΪĪ���ξ���ֽ�IJ����л�����SO3��g����SO2��g����N2��g������BaCl2����������Ļ��Һ����SO3��g������Ʒ����Һ����SO2��g����N2������ˮ����ˮ���ռ�������SO3�ܱ�ˮ��Һ���գ������ȼ���SO3��g�����ټ���SO2��g������NaOH��Һ��ȥSO2���������ˮ���ռ�N2��װ�õĺ�������˳��ΪA��H��F��D��E��G��
����������������װ�õĺ�������˳��ΪA��H��F��D��E��G��
��֤������SO3��ʵ�������ǣ�װ��F�г��ְ�ɫ������
II.��1������K2Cr2O7��Һ����ǿ�����ԣ�Ӧװ����ʽ�ζ����С�Cr2O72-��Fe2+������Fe3+����������ԭ��Cr3+��1molCr2O72-���뷴Ӧ�õ�6mol������1molFe2+���뷴Ӧʧȥ1mol���ӣ����ݵ�ʧ�����غ㡢ԭ���غ�͵���غ㣬�����е����ӷ���ʽΪCr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O��
��2�������ҷ�����װ�ã������������Һ��CaO��Ӧ����NH3���ü�ʯ�ҳ�ȥNH3�е�H2O��g��������������ȡNH3�������a�����NH3��������ˮ��ˮ������NH3��b��������NH3��������ˮ����ˮ��Һ�ʼ��ԣ�����NaHCO3��Һ����NH3��c����NH3������CCl4��������NH3��������������Լ�ΪCCl4����ѡc��
��3�����������������ж���ʵ��ʱ������Ҫ�����¶Ⱥ�ѹǿ������ʵ�����Ҫ�ָ������£�ʹ���������ѹǿ���ڴ���ѹ���ҷ������ռ������岢�ָ������£�����ǰӦ���еIJ����ǣ������ƶ������ܣ��ζ��ܣ���ʹ��������Һ����ƽ��
��4������N�غ㣬25.00mL��Ʒ��n[��NH4��2SO4��FeSO4��6H2O]=![]() n��NH3��=
n��NH3��=![]() mol��500mL��Һ��n[��NH4��2SO4��FeSO4��6H2O]=
mol��500mL��Һ��n[��NH4��2SO4��FeSO4��6H2O]=![]() mol
mol![]() =
=![]() mol��m[��NH4��2SO4��FeSO4��H2O]=
mol��m[��NH4��2SO4��FeSO4��H2O]=![]() mol
mol![]() 392g/mol=
392g/mol=![]() g������������林���Ϊ
g������������林���Ϊ![]() 100%=
100%=![]() 100%��
100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(C3H8)������ȼ�ϵ�غ�п���ؾ�Ϊ��;�㷺��ֱ����Դ���ŵ�ʱ���ߵ��ܷ�Ӧ�ֱ�ΪC3H8+5O2=3CO2+4H2O��2Zn+O2=2ZnO���ñ���(C3H8)ȼ�ϵ��Ϊп���س���װ����ͼ��ʾ������˵������ȷ����

A. ����MΪCO2
B. ȼ�ϵ������1mo1 O2ʱ����������4 mol OH-��bĤ��P�缫�ƶ�
C. aĤ��bĤ������ѡ�������ӽ���Ĥ
D. ��װ���У�п���صĸ�����ӦʽΪZn+2OH--2e-=ZnO+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˫��ˮ��һ����Ҫ����ɫ�Լ�����ҵ�Ͽɲ�ȡ����ϡŨ�ȵ���������ȡ˫��ˮ(H2O2Ϊ��ԭ����)������Ļ�ѧ����ʽΪ��3H2O+3O2![]() O3+3H2O2�������й�˵����ȷ����
O3+3H2O2�������й�˵����ȷ����
A. ���ص���������˫��ˮ���������ɳ���
B. ������H+��������
C. ���������ĵ缫��ӦʽΪ3H2O+6e-=O3+6H+
D. ����˫��ˮ�ĵ缫��ӦʽΪ2H2O-2e- =H2O2+2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�������������ԭ�����͵���ʵ�ǣ� ��
A���غ�ɫ��NO2��ѹ����ɫ�ȱ�����dz
B�����������������⻯��������ɵ�ƽ����ϵ��ѹ����ɫ����
C������ɫ����ˮ���պ���ɫ��dz
D���ϳɰ���ҵʹ�ø�ѹ����߰��IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֳ���������F��һ�ֺ��ɫ�������Ը���ͼ��ת����ϵ���ش��������⡣

��1��д��A��C��F��G�Ļ�ѧʽ��A________��C________��F________��G________��
��2������C��ҺʱҪ�ӹ���A��ԭ����______________________��
��3��д������ת�������ӷ���ʽ��
��D��C��___________________________________________________��
��C��D��___________________________________________________��
��B��C��D__________________________________________________��
��4��д��E��F�Ļ�ѧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ��������������Cl2��Ȳ��������������DZ��Σ�����л��ȴ���������������Ʊ�ClO2�ķ���:
��1������һ�������������ƺ�ϡ����Ϊԭ���Ʊ�����Ӧԭ��Ϊ5NaClO2+4HCl=5NaCl+4ClO2��+2H2O��
�ٸ÷�Ӧ���������ͻ�ԭ�������ʵ���֮����_______________________��
���о�����������Ӧ��ʼʱ����Ũ�Ƚϴ��������������Cl2�������ӷ���ʽ���Ͳ���Cl2��ԭ��____________________________________��
��2�����������Ȼ��Ƶ�ⷨ��
�����ڵ���ʳ��ˮ���ȳ�ȥ���е�Ca2+��Mg2+��SO42-�����ʡ�ij�γ��Ӳ���ʱ��������ˮ���ȼ��������________���ѧʽ�������������ٲ������ټ��������Na2CO3��NaOH����ַ�Ӧ����һ����ȥ��
�ڸ÷�����ԭ��ʾ��ͼ��ͼ��ʾ��������ǽ�ʳ��ˮ���ض������µ��õ��������ƣ�NaClO3�������ᷴӦ����ClO2���������ȷ�����������ClO2�Ļ�ѧ����ʽΪ_________________________________��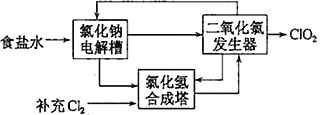
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ָ������ͼʵ��װ���еĴ���֮����(����װ�����ձ��ײ��ѵ���ʯ����)

��_____________________________________����_______________________________________��
��2����ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����______�����ţ���

a���������������� b���ò�������©������������Լӿ�����ٶ�
c������ֽʪ��ʹ�����©���� d����ֽ��Ե�߳�©��
��.��������ȡ���������ͼ����֪���з�����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2KI=2KCl+I2����ش��������⣺

��1��ָ����ȡ��Ĺ������й�ʵ������ٺ͢۵����ƣ�__________��________��
��2����3 mL��ˮ�У�����1mL���Ȼ�̼�������ú۲쵽�Թ���ķֲ���������ͼ�е�________(ע���Թ�����ɫ��Ϊ��ɫ��Һ)���²�_____ɫ��

��ij��Һ�к���MgSO4��Na2SO4�������ʣ�ѡ���ʵ��Լ�����Һ�е�þ����ת��Ϊ��������������������ʵ���������£�

��1����֤����Һ�д���SO42����OH -��ѡ�õķ�������ȡ��������Һ�μ�________��������Һ��죬�������м���________��Һ�����ְ�ɫ���������֤��SO42����OH - �����ڡ�
��2�����ϴ��Mg(OH)2������___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᾧõ��߷�����֬M�ĺϳ�·����ͼ��ʾ��
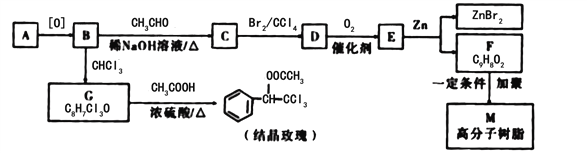
��֪:��A�DZ���ͬϵ��,����ͬ������,������������������ܶ�Ϊ46
��![]()
��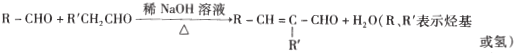
��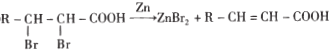
��1��C�к��������ŵ�����Ϊ______��E�Ľṹ��ʽΪ_____��
��2��д����G���ɽᾧõ��Ļ�ѧ����ʽ________________________________��
��3�������������С�C��D����M�ĺϳɹ����е�������___________________________
��4����֪G��һ��������ˮ������![]() ,д��H��������������ͬ���칹��Ľṹ��ʽ______________________________
,д��H��������������ͬ���칹��Ľṹ��ʽ______________________________
a���Ȼ�����Һ������ɫ��Ӧ
b�����ϵ�һ��ȡ����ֻ��һ��
c������������������Һ��Ӧ,![]() ������
������![]() NaOH
NaOH
��5��E��ͬ���칹��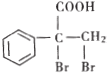 ��һ����Ҫ��ҩ���м���,��ϳ�·����E����,����
��һ����Ҫ��ҩ���м���,��ϳ�·����E����,����![]() Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_______________.
Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_______________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ���Ͻ�Ͷ��400 mLϡ�����У�����ȫ���ܽⲢ�������塣����Ӧ��ȫ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��
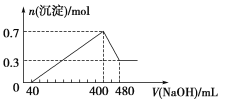
���㣺
��1���Ͻ���Mg������Ϊ________g��
��2����������ʵ���Ũ��Ϊ________ mol��L1��
��3��NaOH��Һ�����ʵ���Ũ��Ϊ________ mol��L1��
��4������H2�ڱ�״���µ����Ϊ________L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com