
【题目】(题文)下列说法正确的是
A. 按系统命名法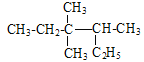 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
C. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
D. 聚乙烯( PE)和聚氯乙烯( PVC)的单体都是不饱和烃,这些单体均能使溴水褪色
【答案】B
【解析】
A项,主链选错;B项,乙酸、氨基乙酸、蛋白质中都含羧基,蛋白质中还含有肽键,羧基、肽键都能与NaOH发生反应;C项,结构上含-CH2OH的醇能催化氧化成醛;D项,聚乙烯的单体为CH2=CH2,聚氯乙烯的单体为CH2=CHCl,CH2=CHCl不属于不饱和烃,CH2=CHCl属于不饱和氯代烃。
A项,主链选错,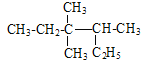 的名称为3,3,4 –三甲基己烷,A项错误;B项,乙酸、氨基乙酸、蛋白质中都含羧基,蛋白质中还含有肽键,羧基、肽键都能与NaOH发生反应,B项正确;C项,结构上含-CH2OH的醇能催化氧化成醛,分子式为C5H12O的能催化氧化成醛的醇的结构简式为:CH3CH2CH2CH2CH2OH、
的名称为3,3,4 –三甲基己烷,A项错误;B项,乙酸、氨基乙酸、蛋白质中都含羧基,蛋白质中还含有肽键,羧基、肽键都能与NaOH发生反应,B项正确;C项,结构上含-CH2OH的醇能催化氧化成醛,分子式为C5H12O的能催化氧化成醛的醇的结构简式为:CH3CH2CH2CH2CH2OH、![]() 、
、![]() 、
、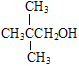 ,共4种,C项错误;D项,聚乙烯的单体为CH2=CH2,聚氯乙烯的单体为CH2=CHCl,CH2=CH2和CH2=CHCl都能使溴水褪色,但CH2=CHCl不属于不饱和烃,CH2=CHCl属于不饱和氯代烃,D项错误;答案选B。
,共4种,C项错误;D项,聚乙烯的单体为CH2=CH2,聚氯乙烯的单体为CH2=CHCl,CH2=CH2和CH2=CHCl都能使溴水褪色,但CH2=CHCl不属于不饱和烃,CH2=CHCl属于不饱和氯代烃,D项错误;答案选B。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O) (相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式______________________________________。
(2)步骤③“酸溶”,最适合选用的酸为______________,为提高酸溶速率,可采取的措施是__________(任意写出一条)。
(3)若步骤④沉铅”后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)从原子利用率的角度分析该流程的优点为_______________________。
(5)步骤⑥“合成”三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__ % (结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用硫酸银与硫黄培烧制备氧化铝,再电解氧化铝,发生反应如下:反应Ⅰ:2A12(SO4)3+3S![]() 2Al2O3+9SO2↑
2Al2O3+9SO2↑
反应Ⅱ:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
下列说法正确的是
A. 反应Ⅰ中S 单质是氧化剂
B. 反应Ⅱ中铝元素被氧化
C. 当生成5.4gAl时,反应Ⅰ和Ⅱ共转移1.2mole-
D. 反应Ⅰ中氧化产物与还原产物物质的量之比为2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
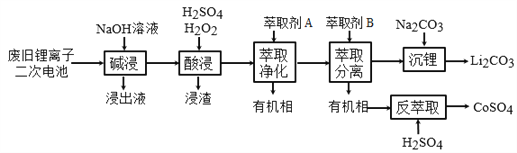
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
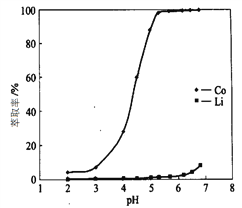
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
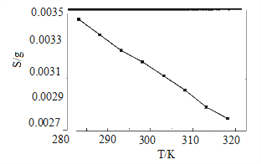
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是
O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B. 电解池中H+移向阴极
C. 产生臭氧的电极反应式为3H2O+6e-=O3+6H+
D. 产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇。已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)=2H2O(l) △H=- 283.0kJ/mol;
②2CH3OH (1)+3O2=2CO2(g)+4H2O(1) △H=- 726.0kJ/mol。
(1)写出二氧化碳与氢气合成甲醇液体的热化学方程式____。
(2)已知:CO2 (g)+3H2 (g)=CH3OH (g)+H2O(g) △H=- 49.0kJ/mol,将6molCO2和8mol H2充入4L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线),图中数据a(l,6)表示在1min时H2的物质的量是6mol。

①b点正反应速率____(填“大于”“等于”或“小于”)逆反应速率。此温度下该反应的平衡常数为____。
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅱ对应的实验条件改变是____,体积不变再充入3 mol CO2和4mol H2,H2O(g)的体积分数____(填“增大”“不变”或“减小”)
Ⅱ.粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)
(1)铅蓄电池的负极电极反应式为 ___。
(2)粗镍提纯的阴极反应式为 ___。电解结束后,阳极附近产生的沉淀物的主要成分为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。现有下列两种制备ClO2的方法:
(1)方法一:可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因____________________________________。
(2)方法二:氯化钠电解法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,二氧化氯发生器中生成ClO2的化学方程式为_________________________________。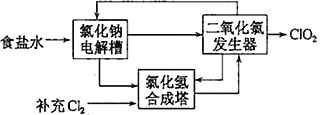
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。
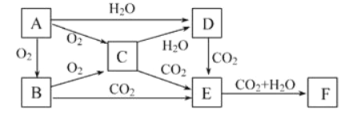
(1)写出下列物质的名称:B____________、E_____。
(2)写出E→F的离子方程式________________________。
F(固体)→E的化学方程式_____________。
(3)写出C与二氧化碳反应的化学方程式为:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com