
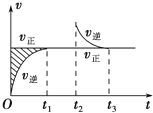
 �����ܱ������������淴Ӧ��Z������+W������?X��g��+Y����������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ���ǣ�������
�����ܱ������������淴Ӧ��Z������+W������?X��g��+Y����������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ���ǣ�������| A�� | Z��W�ڸ���������һ����Ϊ��̬ | |
| B�� | t1��t2ʱ�����t3ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ��������������� | |
| C�� | ���ڸ��¶��´˷�Ӧƽ�ⳣ������ʽΪK=c��X������t1��t2ʱ�����t3ʱ�̺��XŨ�Ȳ���� | |
| D�� | ���÷�Ӧֻ��ij�¶�T0�����Է����У���÷�Ӧ��ƽ�ⳣ��K���¶����߶����� |
���� A����t2ʱ����С�����������ͼ��֪���淴Ӧ������������Ӧ���ʲ��淴Ӧʱ���ѹǿ�ĸı���ı䣻
B������ͼ���֪��ֻ��X�����壬Y����������������壬���Է�Ӧ�����������Ħ������ʼ�ղ���ȣ�
C����ѧƽ�ⳣ��ֻ���¶��йأ����¶���ƽ�ⳣ���ı���ʽK=c��X���Ƕ�ֵ��
D���÷�Ӧ���¶�ΪT0����ʱ�����Է����У����ݡ�H-T��S��0����S��0���ó��÷�Ӧ�����ȷ�Ӧ��
��� �⣺A����t2ʱ����С�����������ͼ��֪���淴Ӧ������������Ӧ���ʲ��淴Ӧʱ���ѹǿ�ĸı���ı䣬��Z��W���������壬��A����
B������ͼ���֪��ֻ��X�����壬Y�����������Ϊ������Һ�壬��YΪ�����Һ��ʱ��ֻ��XΪ���壬��t1��t2ʱ�����t3ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ��������ȣ���B����
C����ѧƽ�ⳣ��ֻ���¶��йأ����¶���ƽ�ⳣ���ı���ʽK=c��X���Ƕ�ֵ����t1��t2ʱ�����t3ʱ�̺��c��X����ȣ���C����
D�����ڸ÷�Ӧ���¶�ΪT����ʱ�����Է����У����ݡ�H-T��S��0����S��0���ó��÷�Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ������D��ȷ��
��ѡD��
���� ���⿼�黯ѧƽ���ƶ�����Ӧ����ͼ��Ϊ��Ƶ���㣬����ѹǿ�Է�Ӧ���ʡ���ѧƽ���ƶ���Ӱ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬��Ŀ�ѶȲ���


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ�
�״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ�| ʵ���� | T����C�� | n��CO��/n��H2�� | p��MPa�� |
| �� | 150 | 1/3 | 0.1 |
| �� | 5 | ||
| �� | 350 | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ��Ӧ | ƽ�� ���� | �¶�/�� | ||
| 500 | 700 | 800 | ||
| ��2H2��g��+CO��g��?CH3OH��g�� | K1 | 2.5 | 0.34 | 0.15 |
| ��H2��g��+CO2��g��?H2O��g��+CO��g�� | K2 | 1.0 | 1.70 | 2.52 |
| ��3H2��g��+CO2��g��?CH3OH��g��+H2O��g�� | K3 | |||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1moN2��3mol H2 | 2mol N2��6mol H2 | 2mol NH3 |
| NH3Ũ�ȣ�mol•L-1�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1kJ | �ų�Q2kJ | ����Q3kJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
| A�� | 2p1=2p3��p2 | |
| B�� | ��2+��3��1 | |
| C�� | �ﵽƽ��ʱ��������NH3������������ | |
| D�� | Q1+Q3��92.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ���Һ | B�� | ������������ | C�� | ����ͭ��Һ | D�� | ������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L �ƾ����еķ�����ΪNA | |
| B�� | 500mL 1moL/L�������к��е�HCl������Ϊ0.5 NA | |
| C�� | ͨ��״���£�NA ��CO2����ռ�е����ԼΪ22.4 L | |
| D�� | ͨ��״���£�71 g Cl2����ԭ����Ϊ2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KClO3������ԭ��Ӧ | |
| B�� | H2C2O4�ڷ�Ӧ�б����� | |
| C�� | H2C2O4��������ǿ��ClO2�������� | |
| D�� | ÿ����1 mol ClO2��ת�Ƶĵ�����ԼΪ6.02��1023 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com