
科目:高中化学 来源:2008年宁夏中卫一中高三第三次模拟考试、理科综合能力测试化学部分 题型:058
某兴趣小组设计出下图所示装置来改进教科书中“铜与硝酸反应”实验,以探究化学实验的“绿色化学”.
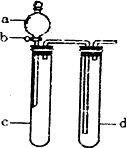
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,用热毛巾捂住C对其加热,其目的是________.
(2)在d中加适量NaOH溶液,c中放足量铜片,由分液漏斗a向c中加人2 mL浓硝酸,c中反应的化学方程式是________;再由a向c中加2 mL蒸馏水,c中的实验现象是________.
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________,理由是________.

(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2.操作步骤为________,实验现象为________.但此实验的不足之处是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com