
【题目】(1)已知20.0g NaOH溶于水配成稀溶液与足量的盐酸反应,放出28.8kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量______ kJ,由此测得的中和热为_____kJ/mol;
(2)已知断开1mol H—H键、1mol Br—Br键、1mol H—Br键分别需吸收的能量为436kJ、193kJ、366kJ。计算H2和Br2反应生成1mol HBr需 _______(填“吸收”或“放出”)能量_________ kJ;
(3)t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
①从反应开始到化学平衡,生成SO3的平均反应速率为____________________ ,平衡时SO2的转化率为__________;
②下列叙述能证明该反应已达到化学平衡状态的是__________(填标号)。
A. 容器内压强不再发生变化
B. SO2的体积分数不再发生变化
C. 容器内气体原子总数不再发生变化
D. 相同时间内消耗2n mol SO2的同时消耗n mol O2
E. 相同时间内消耗2n mol SO2的同时生成n mol O2
③t2℃时,若将物质的量之比n(SO2):n(O2) = 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为___________。
【答案】57.6 57.6 放出 51.5 0.1mol/(L·min) 20% ABE 80%
【解析】
(1)已知20.0g NaOH溶于水配成稀溶液与足量的盐酸反应,放出28.8kJ热量,20g氢氧化钠是0.5mol,生成0.5mol水,因此此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水即1mol时,该反应放出热量57.6 kJ,由此测得的中和热为57.6 kJ/mol;
(2)已知断开1mol H—H键、1mol Br—Br键、1mol H—Br键分别需吸收的能量为436kJ、193kJ、366kJ,由于断键吸热,形成化学键放热,则生成2molHBr的焓变是436kJ/mol+193kJ/mol-2×366kJ/mol=-103kJ/mol,因此H2和Br2反应生成1mol HBr需放出能量51.5kJ;
(3)①2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,因此消耗氧气是1mol-0.8mol=0.2mol,所以生成三氧化硫是0.4mol,浓度是0.2mol/L,则从反应开始到化学平衡,生成SO3的平均反应速率为0.2mol/L÷2min=0.1mol/(L·min),消耗二氧化硫是0.4mol,则平衡时SO2的转化率为0.4/2×100%=20%;
②A. 正反应体积减小,容器内压强不再发生变化说明反应达到平衡状态,A正确;
B. SO2的体积分数不再发生变化说明反应达到平衡状态,B正确;
C. 根据原子守恒可知容器内气体原子总数始终不变,不能据此说明反应达到平衡状态,C错误;
D. 相同时间内消耗2n mol SO2的同时消耗n mol O2均表示正反应速率,不能据此说明反应达到平衡状态,D错误;
E. 相同时间内消耗2n mol SO2的同时生成n mol O2说明正逆反应速率相等,反应达到平衡状态,E正确;
答案选ABE;
③ 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始量(mol) 1 1 0
转化量(mol) x x/2 x
平衡量(mol)1-x 1-x/2 x
反应达到平衡时,混合气体体积减少了20%,则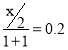 ,解得x=0.8,所以SO2的转化率为80%。
,解得x=0.8,所以SO2的转化率为80%。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丁表明,碱性溶液中,Mn2+越大,H2O2分解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 用图1所示装置制取并收集少量纯净的氨气
B. 用图2 所示装置分离乙醇和乙酸乙酯的混合溶液
C. 用图3所示装置加热分解NaHCO3固体
D. 用图4 所示装置比较KMnO4、Cl2、Br2的氧化性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
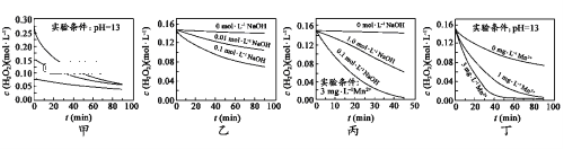
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
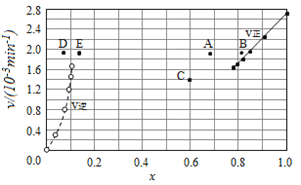
A. A D B. B D C. B E D. A E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=_____,该条件下的平衡常数K=__________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式______________,A的结构简式_______________;
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式___________,反应类型______________;
(3)在碘水中加入B振荡静置后的现象 __________________________________;
(4)B与Br2在FeBr3催化下反应的化学反应方程式_________________________,反应类型___________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量____________(填“A>B”或“A<B”或“A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实与相应结论不正确的是
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
D | 一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列材料中含有硅元素的是( )
①水泥 ②玻璃 ③陶瓷 ④计算机芯片 ⑤压电材料 ⑥光缆
A. ①②③④⑤⑥ B. ①③⑤ C. ①②④ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com