
(共12分)
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
①K=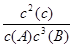 ②不变 增大 ③ 0.01mol/(L·min)
②不变 增大 ③ 0.01mol/(L·min)
(2)① 降温 ②AC
解析试题分析:(1)?反应平衡常数K值只与温度有关,与反应物浓度无关。其他条件相同时,
增大反应物浓度反应速率增大。?计算平均反应速率,以反应物B为例:V(B)=1.5mol/15min
×10L (2)?在t2时反应速率骤降,温度降低,分子运动速率减慢,反应速度也减慢。
?影响反应速率的因素有温度、浓度、压强、催化剂,在t4时反应速率升高,对于有气体
参与的化学反应,其他条件不变时(除体积),增大压强,即体积减小,反应物浓度增大,
速率增加。正催化剂能使反应速率增加。选项D、E升高温度与增大A浓度虽然能使反应速
率增加,但会是平衡移动,故不符合。
考点:反应速率、反应平衡及计算;影响反应速率的因素;
点评:综合考查学生对反应速率章节内容的掌握:
①反应平衡常数K值只与温度有关,与反应物浓度无关。②影响反应速率的因素有温度、浓
度、压强、催化剂;③对于有气体参与的化学反应,其他条件不变时(除体积),增大压强,
即体积减小,反应物浓度增大,速率增加。


科目:高中化学 来源:2011-2012学年四川省南山中学高一5月月考化学试卷(带解析) 题型:填空题
(本题共12分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;54 g D的单质跟足量盐酸反应,生成D3+和67.2 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①B、D的最高价氧化物对应水化物相互反应的离子方程式为: 。
②用电子式表示C与E形成E2C的过程: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为 。
②在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,反应离子方程式是__________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源:2013届山东省淄博一中高三12月阶段性检测化学试卷(带解析) 题型:填空题
(共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④VC-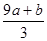 mol
mol
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省高三12月阶段性检测化学试卷(解析版) 题型:填空题
(共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④VC- mol
mol
查看答案和解析>>
科目:高中化学 来源:2013届河北广平县第一中学高二第二次调研考试理科化学试题(解析版) 题型:填空题
(每空2分,共10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_____
A、KMnO4 B、 H2O2 C、 Cl2 水 D、 HNO3
然后再继续加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+
而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)向25 mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,得到曲线如下图所示
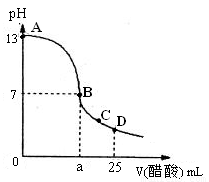
①、写出氢氧化钠溶液与醋酸溶液反应的离子方程式
②、该氢氧化钠溶液的物质的量浓度为
③、在B点,a 12.5 mL(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源:2013届福建省、二中高一下学期联考化学试卷 题型:填空题
(共12分)I.(6分)按要求在下列空格中填出下列有机物的有关式子:
相对分子质量最小的有机物电子式 ,食醋中的有机物结构式 ,糖尿病患者尿液中含的糖类结构简式 。
II.(6分)铍和铝、锂和镁等在元素周期表中具有特殊的“对角线关系”,单质及化合物的性质十分相似。请按要求回答下列各问:
(1)写出Be与NaOH溶液反应的离子方程式(生成Na2BeO2): ;(2)Be(OH)2与Mg(OH)2可用试剂 鉴别,其离子方程式为: ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com