
【题目】核电站遭破坏,会造成放射性物质![]() I和
I和![]() Cs向外界泄漏。下列有关说法错误的是( )
Cs向外界泄漏。下列有关说法错误的是( )
A.每个![]() Cs含有78个中子
Cs含有78个中子
B.CsOH的碱性比KOH的强
C.HI的还原性比HF的强
D.KIO3是碘的最高价含氧酸的盐
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
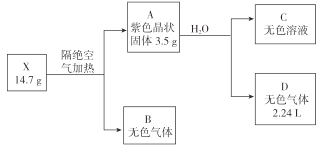
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水 ,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为 __________________ 。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为 ____________。
(4)X受热分解转变成 A 和 B 的化学反应方程式为 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个单环共用一个碳原子的多环化合物称为螺环化合物,共用的碳原子称为螺原子。螺[5,5]十一烷的结构为![]() ,下列关于该化合物的说法错误的是( )
,下列关于该化合物的说法错误的是( )
A.一溴代物有三种
B.与十一碳烯互为同分异构体
C.分子中所有碳原子不可能在同一平面
D.1mo1该化合物完全燃烧需要16mo1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子PMMA是迄今为止合成透明材料中质地最优异、价格又比较适宜的品种。其中一种合成路线如图:
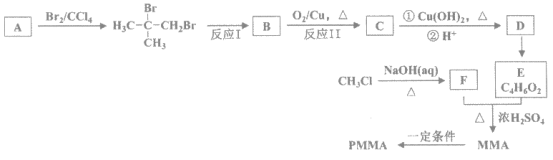
(1)A的分子式是__________。
(2)反应II的化学方程式是____________________。
(3)由MMA制取高分子PMMA的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示;
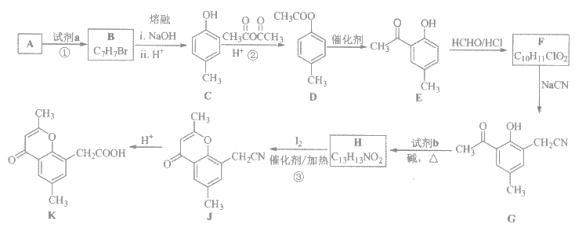
已知部分有机化合物转化的反应式如下:
i、![]() R-CN
R-CN![]() R-COOH(R为烃基)
R-COOH(R为烃基)
ii、![]()
![]()
![]() (R、
(R、![]() 代表烃基或氢)
代表烃基或氢)
iii、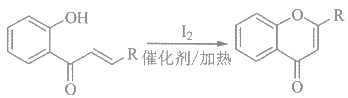 (R、
(R、![]() 代表烃基或氢)
代表烃基或氢)
(1)A的分子式是C7H8,其结构简式是_________;A→B所属的反应类型为_________。
(2)C→D的化学方程式是________________。
(3)写出满足下列条件的D的任意一种同分异构体的结构简式:________。
a 能发生银镜反应 b 与浓溴水反应生成沉淀
c 苯环上有两个取代基,且苯环上的一氯代物有两种
(4)F的结构简式是_________;试剂b是__________________。
(5)H与I2反应生成J和HI的化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

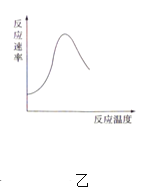


A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示除去氧化膜的镁条投入到稀盐酸中,反应速率v随时间t的变化曲线
D. 图丁表示某温度下V1mLl.0 mol/L HC1溶液和V2 mL1.5mol/L的NaOH溶液混合均匀后溶液温度随V1的变化趋势(V1+V2=50mL)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl![]() Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
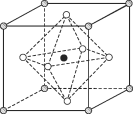
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O(g)=H2O(l) △H=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l) △H=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H=-O3kJ·mol-1,若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A. Q1+Q2+Q3 B. 0.5(Q1+Q2+Q3)
C. 1.5Q1-0.5Q2+0.5Q3 D. 0.5Q1-1.5Q2+0.5Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com