
| A. | 我国古代文献《天工开物》记载“凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测”是因为KNO3能自燃 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| D. | 运用荧光蛋白可以观测到细胞的活动,荧光蛋白是一种高分子化合物且能发生水解 |
分析 A.KNO3不能自燃,受热易分解;
B.碳酸钙溶解度小于硫酸钙,依据沉淀转化原则解答;
C.棉花、优质针叶木主要成分是纤维素;
D.荧光蛋白是一种高分子化合物,含-CONH-.
解答 解:A.由文献可知,KNO3加热后才分解,不能自燃,故A错误;
B.碳酸钙溶解度小于硫酸钙,依据沉淀转化原则,碳酸钠与硫酸钙反应生成碳酸钙和硫酸钠,碳酸钙与盐酸反应生成氯化钙和水、二氧化碳,故B正确;
C.棉花、优质针叶木等原料的主要成分是纤维素,故C正确;
D.荧光蛋白是一种高分子化合物,含-CONH-,可发生水解反应,故D正确;
故选:A.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、组成及发生的反应、环境保护等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
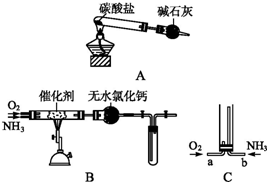
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
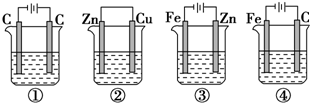
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ①=②>③>④ | D. | ①=②>③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com