
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH·H2O]=1.6×10-4]。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
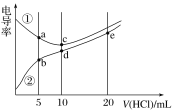
A. d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
B. a点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH·H2O]
C. 曲线①代表滴定二甲胺溶液的曲线
D. b、c、e三点的溶液中,水的电离程度最大的是b点
【答案】A
【解析】
(CH3)2NHH2O)为弱电解质,在溶液中部分电离,等浓度时离子浓度比NaOH小,则导电性较弱,由此可知②为(CH3)2NHH2O的变化曲线,①为NaOH的变化曲线,加入HCl,(CH3)2NHH2O溶液中离子浓度逐渐增大,导电性逐渐增强,NaOH与盐酸发生中和反应,离子浓度减小,由图象可知加入HCl10mL时完全反应,以此解答该题。
A.d点溶液中,存在质子守恒,即:c(H+)=c(OH-)+c[(CH3)2NHH2O],故A正确;
B.①为NaOH的变化曲线,a点溶液中,溶质为等量的NaCl和HCl,故B错误;
C.二甲胺是弱电解质,溶液中离子浓度较小,与盐酸反应后溶液中离子浓度增大,溶液的导电性增强,因此曲线②是滴定二甲胺溶液,故C错误;
D.b点溶液中溶质为(CH3)2NH2Cl和(CH3)2NHH2O,(CH3)2NHH2O电离出氢氧根离子抑制水的电离,c点溶质为NaCl对水的电离无影响,e点的溶液中溶质为(CH3)2NH2Cl和HCl,HCl抑制水的电离,所以c点水的电离程度最大,故D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】下列关于有机物性质的叙述错误的是( )
A. 甲烷和氯气在光照条件下反应产生油状液滴
B. 苯和乙醇均能使酸性高锰酸钾溶液褪色
C. 乙醇催化氧化能生成乙醛
D. 乙烯、苯分子中的所有原子均共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液说法正确的是
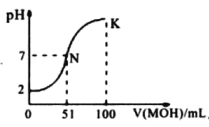
A. 1. 0mol/L NH4HCO3溶液pH=8.0,由此可知Ka1(H2CO3)>Kb (NH3·H2O)>Kaa2(H2 CO3)
B. 向氨水中加入NH4C1固体,溶液中c(NH3·H2O )·c(H+)/c(NH4+)增大
C. 向CH3 COONa溶液中滴加硫酸至中性时,c(SO42-)<c(CH3COOH)
D. 图中曲线可以表示向100mL0.01mol/LCH3COOH溶液中逐滴加入0.02 mol/LNaOH溶液的pH变化情况(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为:
锌粒:Zn + 2OHˉ— 2eˉ= ZnO + H2O
石墨:O2 + H2 + 2eˉ = 2OHˉ。
根据判断,锌片
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。
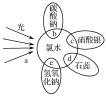
Ⅰ.(1)能证明氯水具有漂白性的是________(填“a”、“b”、“c”或“d”)。
(2)c过程中的现象是__________________________________________________;
e过程中的现象是_________________________________________________,
e过程的反应方程式____________________________________________;
b过程中的化学方程式为______________________________________________。
(3)久置的氯水变为______,用化学反应方程式表示为_____________________。
(4)实验室保存饱和氯水的方法是_______________________________。
Ⅱ.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然褪去。试分析退色的原因:
(1)是由于__________________________________________;
(2)是由于___________________________________________________。
简述怎样用实验证明红色褪去的原因是(1)还是(2):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸最初就是从酸牛奶中得到并由此而得名的。近年来,乳酸成为研究热点之一。利用乳酸 ![]() 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
(1)请写出乳酸分子中官能团的名称_________、__________。
(2)乳酸发生下列变化:![]()
所用的试剂是a__________,b_______(填写化学式)。
(3)乳酸在浓硫酸作用下,两分子相互反应生成环状结构的物质,写出此生成物的结构简式______。
(4)请写出乳酸与乙醇反应的化学方程式__________________________________。
(5)乳酸聚合成的纤维非常适合做手术缝合线,其原因是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com