
【题目】烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
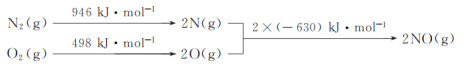
则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为___。
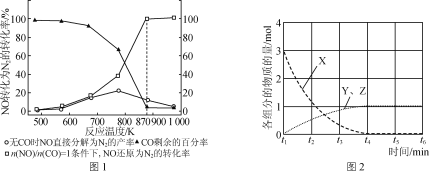
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____。
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:______。
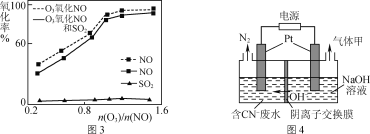
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是____。
②由图3可知SO2对NO的氧化率影响很小的原因是_____。
(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:_____。
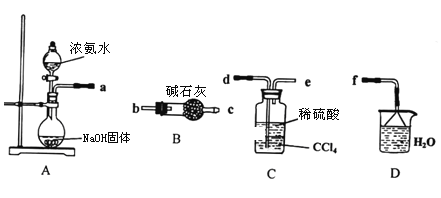
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为_____。
【答案】N2(g)+O2(g)=2NO(g);ΔH=+184 kJ·mol-1 NO的分解反应是放热反应,升温有利于反应逆向进行 3NO![]() N2O+NO2 SO2的氧化消耗了少量O3,减小了O3的浓度 O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快 2xH2S+2NOx=N2+2xH2O+2xS 2CN-+12OH--10e-=2CO32-+N2↑+6H2O
N2O+NO2 SO2的氧化消耗了少量O3,减小了O3的浓度 O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快 2xH2S+2NOx=N2+2xH2O+2xS 2CN-+12OH--10e-=2CO32-+N2↑+6H2O
【解析】
(1)根据反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
(2) 温度超过775 K,发现NO的分解率降低,说明平衡向逆反应方向移动;NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图像可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物书写方程式;
(3)SO2与O3反应导致减小了O3的浓度;SO2对NO的氧化率影响很小,说明臭氧与NO更易反应;
(4) 用天然气中的CH4、H2等还原SO2,S元素化合价降低,在含硫质量分数约为94%的化合物S显-2价,结合质量守恒判断该化合物的化学式,据此分析解答;
(5)由装置图可知,左边为阳极为CN-失电子生成氮气的反应,由此书写电极反应式。
(1)该反应中的反应热=反应物的键能之和-生成物的键能之和=(946+498)kJ/mol-2×630kJ/mol=+184kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g) △H=+184kJmol-1;故答案为:N2(g)+O2(g)=2NO(g) △H=+184kJmol-1;
(2)①若不使用CO,温度超过775 K,发现NO的分解率降低,说明平衡向逆反应方向移动,则该反应正反应为放热反应,故答案为:该反应是放热反应,升高温度反应更有利于向逆反应方向进行;
②NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图像可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,所以方程式为3NO![]() N2O+NO2,故答案为:3NO
N2O+NO2,故答案为:3NO![]() N2O+NO2
N2O+NO2
(3)①SO2与O3反应,减小了O3的浓度,从而使NO的氧化率略低,故答案为:SO2的氧化消耗了少量O3,减小了O3的浓度;
②SO2对NO的氧化率影响很小,说明臭氧与NO更易反应,可说明O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快,故答案为:SO2的氧化消耗了少量O3,减小了O3的浓度;O3氧化SO2反应的活化能较大,O3与NO反应速率比O3与SO2反应速率快;
(4) 用天然气中的CH4、H2等还原SO2,S元素化合价降低,从产物中分离出一种含硫质量分数约为94%的化合物,根据质量守恒,该化合物只能含有H和S元素,为H2S,H2S还原NOx生成氮气和硫,反应的方程式为2xH2S+2NOx=N2+2xH2O+2xS,故答案为:2xH2S+2NOx=N2+2xH2O+2xS;
(5)根据图像,左边电极上CN-转变为N2,失去电子,发生氧化反应,CN-失电子生成氮气,因为溶液显碱性,因此电极反应式为:2CN-+12OH--10e-=2CO32-+N2↑+6H2O,故答案为:2CN-+12OH--10e-=2CO32-+N2↑+6H2O。


科目:高中化学 来源: 题型:
【题目】铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
(1)仪器连接的顺序(用接口序号字母表示)是:a_________________
(2)将装置C中两种液体分离开的操作名称是________________。
(3) (NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意_________________。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为___________________________。
(2)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液 b.析出晶体
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:__________________________________。
②由MgCl2·6H2O制备无水MgCl2的操作在______________氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体熔点由低到高:CH4<SiH4<GeH4<SnH4
B. 熔点由高到低:Rb>K>Na
C. 硬度由大到小:金刚石>![]() 碳化硅>晶体硅
碳化硅>晶体硅
D. 晶格能由大到小:NaF> NaCl> NaBr> NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】推断题善于归纳元素及其化合物之间的转化关系,对学习元素化合物具有重要意义。现有下列物质:金属铁、钠、镁、氯气、氧气、二氧化硫、二氧化碳、水、NaOH溶液、氨水、HCl溶液、KI溶液、稀HNO3、FeCl2溶液。根据要求回答问题:
(1)置换反应是中学常见基本反应类型之一。
①写出非金属单质置换出非金属单质的离子方程式___________________。
②写出金属单质置换出非金属单质的化学反应方程式(任写一个)_________。
(2)“三角转化”是上述单质及其化合物间常见的转化关系之一。现有如图转化关系:

①若X是一种强碱,a是一种酸性氧化物,则Z为________(填“化学式)。
②若Z是一种能够与血红蛋白结合造成人体缺氧的气体,则a的名称为_____。
③若X是常见金属单质,a为含氧酸,则Y![]() Z的离子方程式为__________
Z的离子方程式为__________
请写出检验Z中金属离子的操作:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
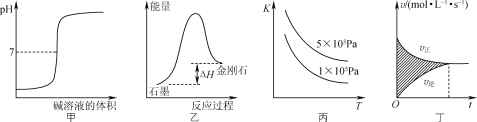
A. 图甲所示,表示强碱滴定强酸的滴定曲线
B. 图乙所示,从能量角度考虑,金刚石比石墨稳定
C. 图丙所示,表示反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
D. 图丁所示,图中的阴影部分面积的含义是[υ(正)-υ(逆)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下:

(1)C中含有的官能团名称为_____。
(2)C→D的反应类型为_____。
(3)已知:G和H的分子式相同,F→G和B→C反应类型也相同,那么G的结构简式为_____。
(4)写出满足下列条件的B的一种同分异构体X的结构简式:_____。
①1molX完全水解消耗2molNaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3∶2∶2∶1。
(5)以乙醇为原料利用GIL合成聚酯![]() 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)。______
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置收集以下7种气体:①H2 ②Cl2 ③O2 ④HCl ⑤NH3 ⑥NO ⑦NO2
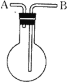
⑴若烧瓶是干燥的,则由B口进气,可收集的气体有___,若把装置颠倒,由A口进气,可收集的气体有____。
⑵若在烧瓶内充满水,可收集的气体有____,气体应由____口进入。
⑶若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有____,气体应由____口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
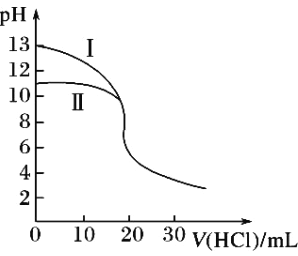
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com