
分析 (1)依据配制溶液体积选择合适容量瓶,依据m=CVM计算需要溶质的质量;
(2)容量瓶为精密仪器,不能盛放过热、过冷的液体,只有在室温下标定的体积才准确;
(3)为保证溶质全部转移的容量瓶,应将烧杯和玻璃棒洗涤2-3次,洗涤液全部转移的容量瓶;
(4)定容的正确操作为:开始直接向容量瓶中加蒸馏水,到离刻度线1-2cm时,应用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)需用0.4mol•L-1 NaOH溶液480mL,因溶液的体积480mL,但容量瓶的规格没有480mL,所以选用500mL容量瓶,需氢氧化钠的质量为m=0.5L×0.4mol•L-1×40g/mol=8.0g;
故答案为:8.0;
(2)容量瓶不能用于盛放过热或者过冷液体,所以稀释后应冷却到室外再进行移液;
故答案为:溶液冷却至室温后;
(3)洗涤操作时应用少量蒸馏水洗涤烧杯2-3次,洗涤后的溶液一起转入容量瓶中,轻轻晃动容量瓶,使溶液混合均匀;
故答案为:2-3;一起转入容量瓶中;
(4)定容时向容量瓶中加入蒸馏水,到液面1~2cm时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切.盖好瓶塞,上下颠倒混合均匀;
故答案为:1~2cm时;胶头滴管;上下颠倒混合均匀;
(5)A.Na2O与水反应生成氢氧化钠,62gNa2O可生成NaOH80g,NaOH的质量增大,所以溶液浓度偏高;
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥,不影响氢氧化钠的质量,对溶液浓度无影响;
C.配制溶液所用的容量瓶洗净后没有烘干,对溶液浓度无影响;
D.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏高;
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;
F.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
G.定容摇匀后静止,液面低于刻度线,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
所以偏高的有ADF,偏低有EG,无影响的是BC,
故答案为:ADF;EG;BC.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及使用注意事项,题目难度不大.


科目:高中化学 来源: 题型:推断题
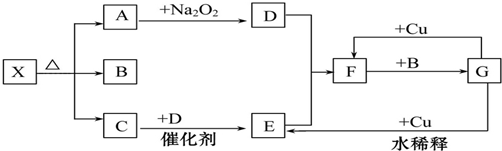
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
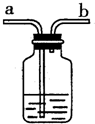
| A. | b导管连接供给氧气的钢瓶 | |
| B. | b导管连接病人吸氧气的塑料管 | |
| C. | 使用该装置用来观测是否有氧气输出 | |
| D. | 使用该装置用来观测氧气输出的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SO3都是极性分子 | |
| B. | 在NH4+和H3O+中都存在配位键 | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,普遍具有熔点高硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
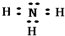 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
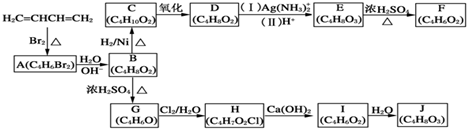
 +H2O,
+H2O,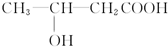 和
和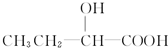 以外,还有
以外,还有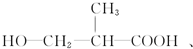 、
、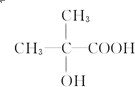 (写出结构简式,不考虑立体异构).
(写出结构简式,不考虑立体异构). ;
;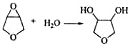 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com