
下列叙述正确的是( )
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则
B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7
C.若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则 NaOH溶液的pH=11
NaOH溶液的pH=11
D.1.0×10-3mol·L-1盐酸的pH=3.0;1.0×10-8mol·L-1盐酸的pH=8.0
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:填空题
白磷和红磷均能在空气中燃烧,且燃烧产物相同,但二者的燃烧热不同,通过实验可测得这两个反应的反应热。
① P4(s,白磷)+
P4(s,白磷)+ O2(g)=
O2(g)= P4O10(s) ΔH1=-745.8 kJ·mol-1
P4O10(s) ΔH1=-745.8 kJ·mol-1
②4P(s,红橉)+5O2(g)=P4O10(s) ΔH2=-2954 kJ·mol-1
(1)白磷和红磷的关系是_____________。
a.同一种物质 b.同位素 c.同分异构体 D.同素异形体
(2)红磷的燃烧热是________kJ·mol-1,白磷 的燃烧热比红磷的燃烧热___________(填“大”或“小”)。
的燃烧热比红磷的燃烧热___________(填“大”或“小”)。
(3)白磷转化为红磷的热化学方程式为P4(s,白磷)=4P(s,红磷)ΔH=-29.2 kJ/mol。在相同的条件下,能量较低的是________(填“白磷”或“红磷”),白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:填空题
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等。
(1)下列ΔH表示物质标准燃烧热的是___________;表示中和反应反应热的是___________。(填“ΔH1”、“ΔH2”、“ΔH3”等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+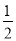 O2(g)===CO(g) ΔH2=-Q1
O2(g)===CO(g) ΔH2=-Q1 kJ·mol-1
kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)===CO2(g) ΔH4=-Q2kJ·mol-1
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
(2 )2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6 kJ的热量,写出该反应的热化学方程式:_________________。
)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6 kJ的热量,写出该反应的热化学方程式:_________________。
(3)根据题(1)中 B、D判断1 molCO(g)完全燃烧的ΔH= 。
B、D判断1 molCO(g)完全燃烧的ΔH= 。
(4)反应E的ΔH6可以用如图所示的装置进行测量。实验中直接测定的数据是  ;
;

从实验装置上看,图中尚缺少的一种玻璃用品是_____________;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值___________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:选择题
从海水中提取下列物质,可以不涉及化学变化的是 ( )
A.K  B.Mg C.Br2 D.NaCl
B.Mg C.Br2 D.NaCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上学期月考二化学卷(解析版) 题型:选择题
对于可逆反应:2A(g)+B(g)  2C(g) △H>0,下列各图中正确的是( )
2C(g) △H>0,下列各图中正确的是( )
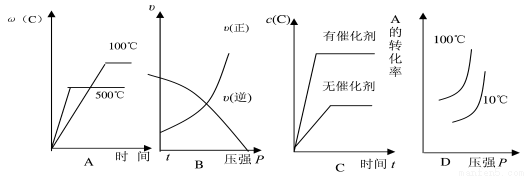
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
(1)溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示。
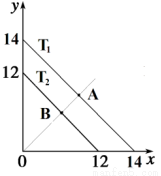
①若从A点到B点,可采取的措施为_________。
②T2 ℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH-)将______(填“增大”、“减小”、“不变”)。
③已知:T1 ℃时, 醋酸的电离常数为 1.8×10-5,则 T1 ℃时, 在 0.5 mol·L-1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的__________ 倍。
④T2 ℃时,将某溶液(此溶液满足 lg [c(H+)/c(OH-)]=10)滴入含 Na+、 HS-、 SO42-、 K+的溶液中,发生反应的离子方程式为___________。
(2)体积均为1 mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图所示:
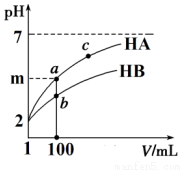
①m的取值为______________。
②a点酸的浓度____________b点酸的浓度(填 “>”、“<”、“=”)。
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是_____________。
A.c(A-) B. n(H+)· n(OH-) C. c(H+)/c(A-) D. c(A-)/[c(HA)· c(OH-)]
(3)已知:25 ℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10-10,K1=4.3×10-7、K2=5.6×10-11,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
将一定量纯净的 X 置于某 10 L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s) 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10-8 mol3·L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 oC时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中化学卷(解析版) 题型:实验题
(1)绿矾晶体(FeSO4﹒7H2〇)由于保存不妥或长久放置,容易部分或全部被氧化,现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂,根据相关的实验现象进行推测(可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液等)。
①证明其完全没有被氧化的试剂是 现象是__________________;
②证明其已完全被氧化的试剂是 现象是____________________。
(2)己知FeSO4.7H2O的溶解度曲线如下图所示,则从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是__________________。
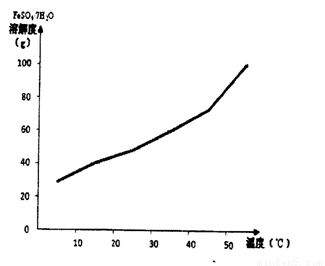
(3)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水
处理等领域具有重要的应用。SPFS可表示成SPFS可表示成Fex(OH)y(SO4)z•nH2O.工业上常用的一种制备流程为:

取5.349g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀8.155g,向上述滤液中加入NH3•H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.000g.确定该固体聚合硫酸铁样品的化学式。(写计算过程)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1MO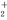 溶液中,恰好完全反应,则还原产物可能是 ( )
溶液中,恰好完全反应,则还原产物可能是 ( )
A.M2+ B.M C.M3+ D.MO2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com