
将1 mol![]() 和3 mol
和3 mol![]() 充入一密闭容器中,使其在一定条件下达到平衡:
充入一密闭容器中,使其在一定条件下达到平衡:![]()
![]()
![]() ,下列哪一状态一定是平衡状态( )
,下列哪一状态一定是平衡状态( )
(1)混合气体的体积等于最初一半的状态;
(2)氮气、氢气和氨的总物质的量不随时间延长而改变的状态;
(3)氮气、氢气和氨的总质量不随时间延长而改变的状态;
(4)单位时间有1 mol氨消耗的同时,就有0.5 mol氮气生成的状态;
(5)单位时间有1 mol氨消耗的同时,有0.5 mol氮气和1.5 mol氢气生成氨的状态;
(6)氮气和氢气体积百分含量之比不随时间延长而改变的状态;
(7)氮气、氢气和氨三者的质量之比不随时间延长而改变的状态;
(8)正、逆反应同时进行的状态;
(9)氢气减少的速率等于氨增加的速率的状态;
(10)氮气、氢气和氨三者浓度相等的状态;
(11)外界条件的改变不影响组成分质量分数的状态;
(12)氨的生成速率与其消耗速率相等的状态.
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:4![]() +5HCHO+H+
+5HCHO+H+![]() 4Mn2++5CO2↑+11H2O
4Mn2++5CO2↑+11H2O
2![]() +5H
+5H![]() 2Mn2++10CO2 ↑+8H2O
2Mn2++10CO2 ↑+8H2O
测定装置:部分装置如下图所示(a、b为止水夹)

测定步骤:
①收集待检新装修的房屋居室空气
②准确量取5.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液于250 mL锥形瓶中,滴入3滴6 mol·L-1的H2SO4溶液,加水45 mL稀释备用。
③将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
完成以下问题:
(1)使用________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?
___________________________。
(3)本实验是否需要外加指示剂?若需要,请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
___________________________。
(4)计算该居室内空气中甲醛的浓度_________mg·m-3,该居室的甲醛_________(填“是”或“否”)超标。
查看答案和解析>>
科目:高中化学 来源:2013届江西省江西师大附中、临川一中高三12月联考化学试卷(带解析) 题型:填空题
(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g) CO(g)+3H2(g) I。
CO(g)+3H2(g) I。
CH4的转化率与温度、压强的关系如图所示。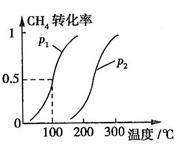
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的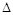 H 0。(填“<”、“>”或“=”)
H 0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g)  H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充人lmolCO和3 mol H2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
 = MPa。
= MPa。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷(解析版) 题型:填空题
(1)在密闭容器中进行下列反应:M(g) + N(g) R(g) + 2L(?) ,此反应规律符合下图图像。
R(g) + 2L(?) ,此反应规律符合下图图像。

①T1 T2 ,正反应的△H 0。(填“>”、“<”或“=”,下同)。
②P1 P2 , L为 。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量 92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是 (填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为 mol、 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省、临川一中高三12月联考化学试卷(解析版) 题型:填空题
(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)  CO(g)+3H2(g)
I。
CO(g)+3H2(g)
I。
CH4的转化率与温度、压强的关系如图所示。
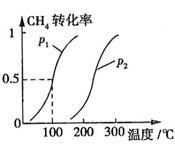
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的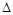 H
0。(填“<”、“>”或“=”)
H
0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g) 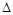 H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充人lmolCO和3 mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
|
实验编号 |
T(℃) |
n(CO)/n(H2) |
p(MPa) |
|
l |
150 |
1/3 |
0.1 |
|
2 |
n |
1/3 |
5 |
|
3 |
350 |
m |
5 |
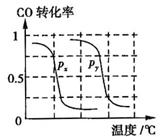
a.上表中剩余的实验条件数据:n= ,m= 。
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强 = MPa。
= MPa。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com