
反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。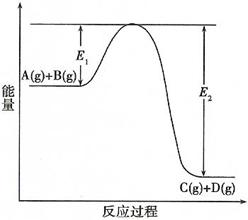
(1)该反应是____________________反应(填“吸热”、“放热”)。
(2)反应体系中加入催化剂对反应热是否有影响?_________,原因是 .
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
某实验需要450ml 0.1mol/L的NaOH溶液,配制这种浓度的溶液时,下列有关说法正确的是( )
A.配制时称量NaOH的质量(表达式)为:0. 45 L×0.1 mol/L×40 g/mol
B.实际上需要配制的NaOH溶液为500mL
C.NaOH固体溶解后要立即将溶液转移至容量瓶中
D.定容摇匀后,发现液面低于刻度线,应补水至液体凹液面与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL硝酸和硫酸的混合溶液中,加入50mL 4 mol·L-1的NaOH溶液,恰好完全中和,然后再向反应后的混合溶液中加入足量BaCl2溶液,可得到得沉淀11.65g
求:
⑴原混合溶液中H+的物质的量浓度。
⑵原混合溶液中所含HNO3的质量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
对反应A+3B 2C来说,下列反应速率中最快的是( )
2C来说,下列反应速率中最快的是( )
A.v(A)=0.3 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.5 mol/(L·min) D.v(A)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容的容器中进行反应N2O4(g)  2NO2(g);△H>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么,反应物浓度由0.06mol/L降到0.024mol/L,需反应的时间为 ( )
2NO2(g);△H>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么,反应物浓度由0.06mol/L降到0.024mol/L,需反应的时间为 ( )
A.等于18s B.大于18s C.等于12s D.小于18s
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是 
























 ( ) A.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
( ) A.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
B.Ba(NO3)2 溶于水,可将含Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C. 不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硫酸溶液中和
D. 酒精灯不慎着火,应立即用水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
取100 mL 0.3 mol/L和300 mL 0.25 mol/L的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是 ( )
A.0.21 mol/L B.0.42 mol/L C.0.56 mol/L D.0.24 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示法正确的是( )
|
| A. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 |
|
| B. | 需要加热的反应说明它是吸热反应 |
|
| C. | 在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
|
| D. | 1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=﹣297.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中,配制溶液肯定不需要的是__________________________ (填序号),配制上述溶液还需用到的玻璃仪器有 (填仪器名称)。
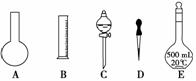
②配制0.1 mol/L NaOH溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.将容量瓶盖紧,振荡,摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
C.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制0.1 mol/L NaOH溶液时,在实验中其他操作均正确,若定容时仰视容量瓶刻度线,则所配溶液浓度 0.1 mol/L(填“大于”、“等于”或“小于”)。
④配制0.5 mol/L硫酸溶液500 mL时,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。
⑤配制0.5 mol/L硫酸溶液时,在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度 0.5 mol/L(填“大于”、“等于”或“小于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com