
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中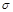 键与 键与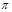 数目比为1:2 数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2EC3(g) △H<0,回答下列问题:
2EC3(g) △H<0,回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Th 元素的质量数是232 | B.Th 元素的相对原子质量是231 |
| C.232Th 转换成233U是化学变化 | D.230Th和232Th的化学性质几乎相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.热稳定性:Y的气态氢化物<Z的气态氢化物 |
| B.X的最高价氧化物对应水化物的酸性比Y的强 |
| C.X元素的单质能与所有强酸发生反应放出H2 |
| D.R元素的单质化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
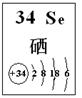
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 | | |
| 3 | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com