
| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
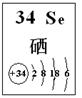
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 | | |
| 3 | | |
| 1 | 性质预测 | 化学方程式 |
| 2 | 还原性 | H2SeO3+Cl2+H2O=" " H2SeO4+2HCl |
| 3 | 酸性 | H2SeO3+2NaOH=Na2 SeO3+2H2O. |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电子层结构相同的微粒,其化学性质一定相似 |
| B.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C.非金属元素的原子两两结合形成的化合物不一定是共价化合物 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.元素铯的两种核素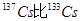 多4个质子 多4个质子 |
| B.P、S、C1得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C.元素原子的最外层电子数越多,越容易得电子 |
| D.从上到下,第VIIA族元素氢化物的热稳定性和还原性均依次减弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
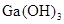 是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________。
是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com