
،¾جâؤ؟،؟زرضھAخھµ»ئة«¹ججه£¬T،¢R خھء½ضض³£¼ûµؤسأح¾¹م·؛µؤ½ًتôµ¥ضت£¬D¾كسذ´إذشµؤ؛عة«¾§جه£¬Cتاخقة«خقخ¶µؤئّجه£¬Hتا°×ة«³ءµي£¬ازشع³±تھ؟صئّضذر¸ثظ±نخھ»زآجة«£¬×îضص±نخھ؛ى؛ضة«¹ججه،£
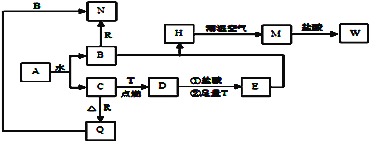
£¨1£©ذ´³ِدآءذخïضتµؤ»¯ر§ت½£؛D:_____________ R: _________
£¨2£©°´زھاَذ´³ِدآءذ·´س¦·½³جت½
Aسëث®·´س¦µؤ»¯ر§·½³جت½ ________________________
BسëR·´س¦µؤہë×س·½³جت½ ________________________
H×ھ»¯خھMµؤ»¯ر§·½³جت½ _______________________
£¨3£©دٍRµؤرخبـز؛ضذµخ¼سبُ¼î£¬؟ةضئµأز»ضض¾كسذخü¸½ذشµؤ°×ة«½؛×°خïضت£¬¸أ·´س¦µؤہë×س·½³جخھ____________________________________
،¾´ً°¸،؟ Fe3O4 Al 2 Na2O2 + 2 H2O= 4 NaOH + O2،ü 2Al+2OH-+2H2O=2AlO2-+3H2،ü 4Fe(OH)2+2H2O+O2=4Fe(OH)3 Al3+ + 3NH3.H2O = Al(OH)3، + 3NH4+
،¾½âخِ،؟Aخھµ»ئة«¹ججهإذ¶دخھNa2O2£¬Dتا¾كسذ´إذشµؤ؛عة«¾§جهإذ¶دخھFe3O4£¬Cتاخقة«خقخ¶µؤئّجهتا¹رُ»¯ؤئسëث®·´س¦ةْ³ةµؤرُئّ£¬BخھNaOH£¬Wبـز؛ضذ¼سبëKSCN³ِدضرھ؛ىة«£¬ثµأ÷W؛¬سذب¼غجْہë×س£»T،¢Rخھء½ضض³£¼ûµؤسأح¾؛ـ¹مµؤ½ًتôµ¥ضت£¬TشعCضذب¼ةصةْ³ةDخھثؤرُ»¯بجْ£¬بـسعرخثلةْ³ةبـز؛ضذ؛¬سذراجْہë×س؛حب¼غجْہë×س£¬¼سبë¹ء؟جْ·´س¦ةْ³ةراجْہë×س£¬ض¤أ÷TخھFe£»EخھFeCl2£¬HخھFe(OH)2£¬MخھFe(OH)3£¬WخھFeCl3£»½ًتôRسëBاâرُ»¯ؤئ·´س¦ثµأ÷R½ًتôخھAl£¬NخھNaAlO2£¬QخھAl2O3£»£¨1£©Dµؤ»¯ر§ت½خھ£؛Fe3O4; Rµؤ»¯ر§ت½خھ£؛Al£»£¨2£©Aسëث®·´س¦µؤ»¯ر§·½³جت½خھ2 Na2O2 + 2 H2O= 4 NaOH + O2،ü£»BسëR·´س¦µؤہë×س·½³جت½ خھ2Al+2OH-+2H2O=2AlO2-+3H2،ü£»H×ھ»¯خھMµؤ»¯ر§·½³جت½خھ4Fe(OH)2+2H2O+O2=4Fe(OH)3£»£¨3£©دٍRµؤرخبـز؛ضذµخ¼سبُ¼î£¬؟ةضئµأز»ضض¾كسذخü¸½ذشµؤ°×ة«½؛×°خïضت£¬¸أ·´س¦µؤہë×س·½³جخھAl3+ + 3NH3.H2O = Al(OH)3، + 3NH4+



| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟أ¹·سثلُ¥£¨MMF£©تائ÷¹ظزئض²ضذزضضئد¸°ûشِض³×î³£سأµؤز©خدآءذثµ·¨صب·µؤتا£¨ £© 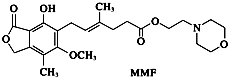
A.MMFؤـبـسعث®
B.1 mol MMFؤـسë؛¬3 mol NaOHµؤث®بـز؛حêب«·´س¦
C.1 mol MMFؤـسë6 molاâئّ·¢ةْ¼س³ة·´س¦
D.MMFؤـ·¢ةْب،´ْ·´س¦؛حدûب¥·´س¦
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟ؤ³خآ¶بدآ£¬H2£¨g£©+CO2£¨g£©H2O£¨g£©+CO£¨g£©µؤئ½؛â³£تK= ![]() £®¸أخآ¶بدآشع¼×،¢زز،¢±ûب¸ِ؛مبفأـ±صبفئ÷ضذ£¬ح¶بëH2£¨g£©؛حCO2£¨g£©£¬ئنئًت¼إ¨¶ببç±يثùت¾£®دآءذإذ¶د²»صب·µؤتا£¨ £©
£®¸أخآ¶بدآشع¼×،¢زز،¢±ûب¸ِ؛مبفأـ±صبفئ÷ضذ£¬ح¶بëH2£¨g£©؛حCO2£¨g£©£¬ئنئًت¼إ¨¶ببç±يثùت¾£®دآءذإذ¶د²»صب·µؤتا£¨ £©
ئًت¼إ¨¶ب | ¼× | زز | ±û |
c£¨H2£©/mol/L | 0.010 | 0.020 | 0.020 |
c£¨CO2£©/mol/L | 0.010 | 0.010 | 0.020 |
A.ئ½؛âت±£¬ززضذCO2µؤ×ھ»¯آت´َسع60%
B.ئ½؛âت±£¬¼×ضذ؛ح±ûضذH2µؤ×ھ»¯آت¾ùتا60%
C.ئ½؛âت±£¬±ûضذc£¨CO2£©تا¼×ضذµؤ2±¶£¬تا0.012mol/L
D.·´س¦؟ھت¼ت±£¬±ûضذµؤ·´س¦ثظآت×î؟ى£¬¼×ضذµؤ·´س¦ثظآت×îآ
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذأèتِضذ£¬²»صب·µؤتا£¨ £©
A. 14Nسë15N¾كسذدàح¬µؤضت×ست B. 18O؛ح17O¾كسذدàح¬µؤµç×ست
C. 18Oسë19F¾كسذدàح¬µؤضذ×ست D. 12Cسë13C¾كسذدàح¬µؤضتء؟ت
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟ء½ضض½ًتô»ى؛د·غؤ©15g£¬سë×مء؟µؤرخثل·´س¦ت±ةْ³ة11.2L H2£¨±ê؟ِدآ£©£¬·û؛دةدتِاé؟ِµؤ½ًتô»ى؛دخïتا£¨ £©
A. Mg،¢Fe B. Zn،¢Ag C. Fe،¢Zn D. Mg،¢Al
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟£¨14·ض£©
رذ¾؟ذ،×éسأدآح¼×°ضأضئب،Cl2£¬ض¤أ÷²ْةْµؤئّجهضذ؛¬سذHCl،£
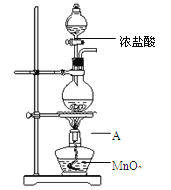
£¨1£©زائ÷Aµؤأû³ئخھ £»Aضذ·´س¦µؤہë×س·½³جت½خھ ،£
£¨2£©¼×ح¬ر§½«Aضذ²ْةْµؤئّجهح¨بëدآءذبـز؛£؛
تµرéذٍ؛إ | تش¼ء | دضدَ |
a | ×دة«ت¯بïبـز؛ |
|
b | AgNO3بـز؛ | ³ِدض°×ة«³ءµي |
¢ظتµرéaضذµؤدضدَخھ ،£
¢ع²»ؤـض¤أ÷²ْةْµؤئّجهضذ؛¬سذHClµؤتµرéتا £¨جî×ضؤ¸ذٍ؛إ£©،£
£¨3£©زرضھ½«HClئّجهح¨بë±¥؛حت³رخث®ضذسذ°×ة«¹ججهخِ³ِ،£ززح¬ر§½«Aضذ²ْةْµؤئّجهح¨بë±¥؛حت³رخث®ضذ£¬سذ°×ة«¹ججهخِ³ِ£¬µ«¸أتµرé²»ؤـض¤أ÷ئّجهضذ؛¬سذHCl£¬½ل؛د»¯ر§سأسï½âتحئنشزٍ£؛ ،£
£¨4£©زرضھ£؛2S2O32- + I2 === S4O62- + 2I-،£±ûح¬ر§½«Aضذ²ْةْµؤئّجهح¨بëصôءَث®ضذ£¬µأµ½بـز؛X£¬½ّذذزشدآتµرéض¤أ÷ئّجهضذ؛¬سذHCl،£
I£®²â¶¨Xضذبـ½âµؤCl2،£ب،25.00 mLبـز؛X£¬¼سبë¹ء؟KIبـز؛£¬ب»؛َسأ0.04 molL-1 Na2S2O3بـز؛µخ¶¨ةْ³ةµؤI2£¬´ïµخ¶¨ضصµمت±دû؛ؤNa2S2O3بـز؛V mL،£
II£®²â¶¨XضذClشھثط×ـء؟،£ءيب،25.00 mLبـز؛X£¬ر،سأتتµ±µؤ»¹ش¼ء½«بـ½âµؤCl2ب«²؟»¹شخھCl-£¬شظسأ0.10 molL-1 AgNO3بـز؛µخ¶¨ثùµأبـز؛ضذµؤCl-،£
XضذµؤHClO²»»لس°دىIµؤ²â¶¨½ل¹û£¬شزٍتا ،£
سةI،¢II ضذتµرéت¾ف؟ةض¤أ÷Aضذ²ْةْµؤئّجهضذ؛¬سذHCl£¬شٍIIضذدû؛ؤ0.10 molL-1 AgNO3بـز؛µؤجه»س¦´َسع mL£¨سأ؛¬Vµؤ´ْتت½±يت¾£©،£
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟¸ù¾فثùر§ضھت¶حê³ةجâؤ؟£؛
£¨1£©£¨¢ٌ£©زرضھشع448،وت±£¬·´س¦H2£¨g£©+I2£¨g£©2HI£¨g£©µؤئ½؛â³£ت K1خھ49£¬شٍ¸أخآ¶بدآ·´س¦2HI£¨g£©H2£¨g£©+I2£¨g£©µؤئ½؛â³£تK2خھ![]() £»·´س¦
£»·´س¦ ![]() H2£¨g£©+
H2£¨g£©+ ![]() I2£¨g£©HI£¨g£©µؤئ½؛â³£تK3خھ £®
I2£¨g£©HI£¨g£©µؤئ½؛â³£تK3خھ £®
£¨2£©£¨¢ٍ£©شعز»¶¨جه»µؤأـ±صبفئ÷ضذ£¬½ّذذبçدآ»¯ر§·´س¦£؛CO2£¨g£©+H2£¨g£©CO£¨g£©+H2O£¨g£©£¬ئن»¯ر§ئ½؛â³£تK؛حخآ¶بtµؤ¹طدµبçدآ±يثùت¾£؛
t/،و | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
»ط´ًدآءذختجâ£؛
¢ظ¸أ·´س¦µؤ»¯ر§ئ½؛â³£ت±ي´ïت½خھK= £®
¢ع¸أ·´س¦خھ·´س¦£¨جî،°خüبب،±»ٍ،°·إبب،±£©£®
¢غؤـإذ¶د¸أ·´س¦´ïµ½»¯ر§ئ½؛â×´ج¬µؤزہ¾فتا £®
A£®بفئ÷ضذر¹ا؟²»±ن B£®»ى؛دئّجهضذc£¨CO£©²»±ن C£®v£¨H2£©ص=v£¨H2O£©ؤو D£®c£¨CO2£©=c£¨CO£©
¢ـشع800،وت±£¬·¢ةْةدتِ·´س¦£¬ؤ³ز»ت±؟ج²âµأبفئ÷ؤع¸÷خïضتµؤإ¨¶ب·ض±ًخھc£¨CO2£©خھ2mol/L£¬c£¨H2£©خھ1.5mol/L£¬c£¨CO£©خھ1mol/L£¬c£¨H2O£©خھ3mol/L£¬شٍدآز»ت±؟ج£¬·´س¦دٍ£¨جî،°صدٍ،±»ٍ،°ؤودٍ،±£©½ّذذ£®
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟ثل¼îضذ؛ح·´س¦µؤ±¾ضتتا£؛H+ + OH£ = H2O£¬دآءذخïضت¼نµؤ·´س¦؟ةزشسأةدتِہë×س·½³جت½±يت¾µؤتا( )
A. اâرُ»¯جْ؛حد،رخثل·´س¦ B. Ba(OH)2بـز؛µخبëد،ءٍثلضذ
C. ³خاهت¯»زث®؛حد،دُثل·´س¦ D. °±ث®سëرخثل
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟سزح¼×°ضأضذ·¢ةْ·´س¦µؤہë×س·½³جت½خھ£؛Zn£«2H£«=Zn2£«£«H2،ü£¬دآءذثµ·¨´يخَµؤتا
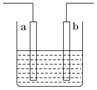
A. a،¢b²»؟ةؤـتاح¬ضض²ؤءدµؤµç¼«
B. ¸أ×°ضأ؟ةؤـتاµç½â³ط£¬µç½âضتبـز؛خھد،رخثل
C. ¸أ×°ضأ؟ةؤـتاشµç³ط£¬µç½âضتبـز؛خھد،رخثل
D. ¸أ×°ضأ؟ة؟´×÷تاح£ذ؟شµç³ط£¬µç½âضتبـز؛تاد،ءٍثل
²é؟´´ً°¸؛ح½âخِ>>
¹ْ¼تر§ذ£سإر، - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com