
【题目】下列关于能量转换的认识中不正确的是
A.电解水生成氢气和氧气时,电能转化为化学能
B.白炽灯工作时,电能全部转化为光能
C.煤燃烧时,化学能主要转化为热能
D.绿色植物进行光合作用时,太阳能转化为化学能
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物。随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要。下图是含铬工业废水和含氰废水的处理流程:
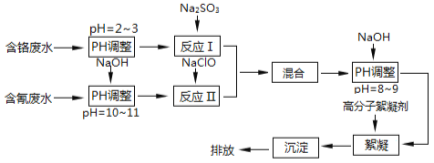
请回答下列问题:
(1)电镀废水中的铬主要以CrO42—形式存在,其中Cr元素的化合价为 。
(2)酸性条件下,CrO42—极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为 。
(3)pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN—)氧化为无毒的两种物质,这两种物质是 、 (写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 。
(4)经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 。
(5)含氰废水及含铬废水可以通过电化学的方法进行无害化处理。
①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应式是 。
②电解法处理酸性含铬废水(若铬元素以Cr2O72—形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。则阳极的电极反应式为 ,当有1 mol Cr2O72—被还原时,电路中转移的电子为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】骨架型镍催化剂因其具有多孔结构对氢气有极强吸附性,故常用作加氢反应的催化剂。一种镍铜硫化矿(主要成分为Ni2S和Cu2S)为原料制备骨架型镍的工艺流程如下:
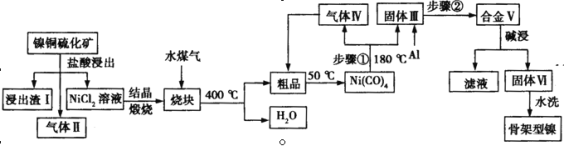
⑴镍铜硫化矿酸浸所得的浸出渣Ⅰ的主要成分是Cu2S,气体Ⅱ中主要含有两种成分,则该步反应的化学方程式为 ;
⑵写出步骤①的化学方程式 。合金Ⅴ在碱浸前要粉碎,粉碎的目的是 ;
⑶碱浸时选择浓NaOH溶液,反应的离子方程式是: ;
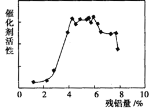
⑷碱浸后残铝量对骨架型镍的催化活性有重大影响。分析如图,残铝量在 范围内催化剂活性最高,属于优质产品;
⑸使用新制骨架型镍进行烯烃加氢反应,有时不加入氢气也可以完成反应,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法中正确的是
A.1.68gFe和足量水蒸气反应,转移的电子数目为0.09NA
B.由31H和168O组成的超重水11g,其中所含的中子数为6NA
C.1L1mol·L-1的NaClO溶液中含有ClO-的数目为NA
D.1mol白磷(P4)分子中所含共价键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如:
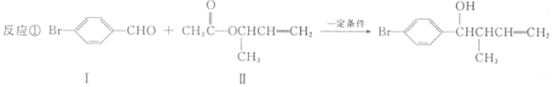
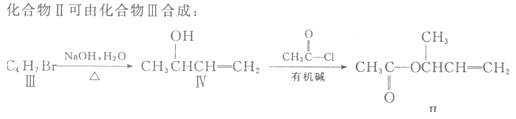
(1)化合物I的分子式为 。
(2)化合物Ⅱ与Br2加成的产物的结构简式为 。
(3)化合物Ⅲ的结构简式为 。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为 因此,在碱性条件下,由Ⅳ与CH3CO--Cl反应合成Ⅱ,其反应类型为 。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为 (写出其中一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
X | 地壳中含量最高的非金属元素 |
Y | M层比K层多1个电子 |
Z | 最外层电子数为内层电子数的0.6倍 |
W | 与氯形成的氯化物是生活中常用的调味品 |
(1)X形成的双原子分子的结构式为 ,X形成的氢化物的沸点在同族元素形成的氢化物中是 (填“最高”或“最低”),原因是 。
(2)金属冶炼Y单质的化学方程式为 。
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为 。
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是 (填化学式),检验该气体的常用试剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )

A. 0-20 s内平均反应速率v(N2O5)="0.1" mol·L-1·s-1
B. 10 s时,正、逆反应速率相等,达到平衡
C. 20 s时,正反应速率大于逆反应速率
D. 曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、生产和社会可持续发展密切相关,下列叙述正确的是( )
A.水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品
B.氧化铝和氧化镁都是电解质,工业上可用于电解制取铝和镁
C.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体
D.静电除尘、燃煤固硫、汽车尾气催化净化都可以提高空气质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)2CO(g).
①该反应为 反应(填“吸热”或“放热”).
②该反应的反应速率随时间的变化图象如图所示,则下列说法正确的是 (填序号).
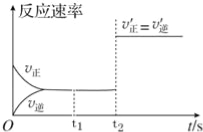
a.t1时刻该反应已经处于化学平衡状态
b.t2时刻c(CO2)=c(CO)
c.t2时刻该反应仍然处于化学平衡状态
d.t2时刻,改变的条件可能是增大了C的物质的量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com