
【题目】骨架型镍催化剂因其具有多孔结构对氢气有极强吸附性,故常用作加氢反应的催化剂。一种镍铜硫化矿(主要成分为Ni2S和Cu2S)为原料制备骨架型镍的工艺流程如下:
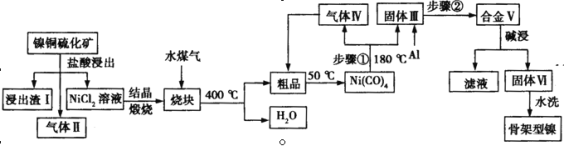
⑴镍铜硫化矿酸浸所得的浸出渣Ⅰ的主要成分是Cu2S,气体Ⅱ中主要含有两种成分,则该步反应的化学方程式为 ;
⑵写出步骤①的化学方程式 。合金Ⅴ在碱浸前要粉碎,粉碎的目的是 ;
⑶碱浸时选择浓NaOH溶液,反应的离子方程式是: ;
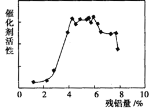
⑷碱浸后残铝量对骨架型镍的催化活性有重大影响。分析如图,残铝量在 范围内催化剂活性最高,属于优质产品;
⑸使用新制骨架型镍进行烯烃加氢反应,有时不加入氢气也可以完成反应,原因是 。
【答案】
(1)Ni2S+4HCl=2NiCl2+H2S↑+H2↑
(2)Ni(CO)4![]() Ni+4CO↑;使合金在碱浸时充分反反应,并加快反应速率
Ni+4CO↑;使合金在碱浸时充分反反应,并加快反应速率
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
(4)4%~6%
(5)骨架型镍的多孔结构吸收了碱浸时产生的氢气
【解析】
试题分析:⑴镍铜硫化矿(主要成分为Ni2S和Cu2S)酸浸所得的浸出渣Ⅰ的主要成分是Cu2S,Ni2S与盐酸反应生成NiCl2和气体Ⅱ,气体Ⅱ中主要含有两种成分,根据化合价的变化,Ni盐酸的化合价由+1价变成+2价升高,则只能是H盐酸的化合价降低到0价,生成氢气,另外一种应该是硫化氢,反应的化学方程式为Ni2S+4HCl=2NiCl2+H2S↑+H2↑,故答案为:Ni2S+4HCl=2NiCl2+H2S↑+H2↑;
⑵根据流程图,合金Ⅴ是镍和铝的合金,因此步骤①是Ni(CO)4分解生成镍和一氧化碳,化学方程式为Ni(CO)4![]() Ni+4CO↑,合金Ⅴ在碱浸前要粉碎,粉碎的目的是使合金在碱浸时充分反反应,并加快反应速率,故答案为:Ni(CO)4
Ni+4CO↑,合金Ⅴ在碱浸前要粉碎,粉碎的目的是使合金在碱浸时充分反反应,并加快反应速率,故答案为:Ni(CO)4![]() Ni+4CO↑;使合金在碱浸时充分反反应,并加快反应速率;
Ni+4CO↑;使合金在碱浸时充分反反应,并加快反应速率;
⑶碱浸时浓NaOH溶液将铝溶解,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
⑷根据图像,残铝量在4%~6%时催化剂活性最高,故答案为:4%~6%;
⑸骨架型镍的多孔结构吸收了碱浸时产生的氢气,在进行烯烃加氢反应,可以不加入氢气也可以完成反应,故答案为:骨架型镍的多孔结构吸收了碱浸时产生的氢气。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( )
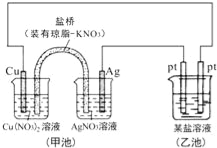
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3﹣的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论错误的是
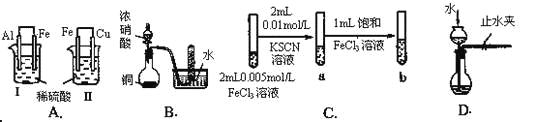
实验 | 实验现象 | 结论 |
A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废气中含有CO、SO2、NO等有毒气体,为了更有效地治理该废气,某研究小组分别设计了如下两个方案:
方案(1):治理含CO、SO2的烟道气,以Fe2O3作催化剂,将CO、SO2在380℃时转化为S和一种无毒气体。
已知:ⅰ.硫的熔点112.8℃,沸点444.6℃;
ⅱ.反应每得到1mol硫,放出270kJ的热量。
①写出该治理烟道气反应的热化学方程式: 。
②其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如下图。不考虑催化剂价格因素,生产中选Fe2O3作催化剂的主要原因是 。
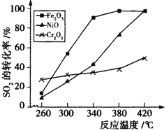
方案(2):用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①10min~20min以v(CO2)表示的反应速率为 。
②根据表中数据,T1℃时该反应的平衡常数为 (保留两位有效数字)。
③下列各项能作为判断该反应达到平衡状态标志的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,NO的平衡转化率 (填“增大”、“减小”或“不变”)
⑥50min时,保持其他条件不变,往容器中再充入0.32 mol NO和0.34mol CO2,平衡将向 方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2的反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是
A. 离子半径:Al3+>Mg2+>F-
B. 热稳定性:HI>HBr>HCl>HF
C. 酸性:H2SiO3<H3PO4<H2SO4<HClO4
D. 碱性:Al(OH)3>Mg(OH)2>NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A.电解水生成氢气和氧气时,电能转化为化学能
B.白炽灯工作时,电能全部转化为光能
C.煤燃烧时,化学能主要转化为热能
D.绿色植物进行光合作用时,太阳能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( )

A.电极Ⅱ逐渐溶解
B.电极Ⅰ发生还原反应
C.电流方向:电极Ⅳ→A→电极Ⅰ
D.电极Ⅲ的电极反应:Cu2+ + 2e- = Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com