
下列说法正确的是
| A.在“食醋总酸含量的测定”实验中,选择酚酞溶液为指示剂,当溶液的颜色变为粉红色且在半分钟内不褪色,即达到滴定终点 |
| B.在“牙膏中某些主要成分的检验”实验中,在牙膏与蒸馏水搅拌、静置分离后的澄清溶液中加入少量的新制Cu(OH)2,当产生绛蓝色沉淀时,说明牙膏中含有甘油 |
| C.在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用酒精洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率。 |
| D.人体吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒;氨气、溴中毒休克时要马上进行人工呼吸 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下列原理或操作不正确的是
A.在如图装置的稀硫酸中加入适量重铬酸钾或适量6%的H2O2溶液,可以使灯泡亮度增大,持续时间变长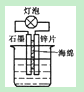 |
| B.在提纯混有少量NaCl的KNO3时,常先将混合物在较高温度下溶于水形成浓溶液,再经过冷却结晶、过滤、洗涤、干燥,获得KNO3晶体 |
| C.制摩尔盐时用酒精洗涤产品,用干净的滤纸吸干;而在制阿司匹林粗品时用冷水洗涤产品,在空气中风干 |
| D.纸层析法分离微量成份时均需有以下流程:装置制作—→点层析试样—→配制展开剂—→层析操作—→显色反应。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室中以下物质的贮存方法不正确的是( )
| A.少量液溴可用水封存,防止溴挥发 |
| B.少量金属钠保存在煤油中 |
| C.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
| D.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
完成下列实验所选择的试剂、装置或仪器(夹持装置已略去)正确的是
| | A | B | C | D |
| 实验 | 用酒精提取溴水中的Br2 | 滴定管读数 | 证明非金属性强弱S>C>Si | 收集C12 |
| 装置或仪器 | 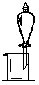 | 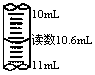 |  | 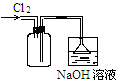 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验成功离不开正确的操作及数据记录。实验操作、记录正确的是
| A.滴定管装液前只需水洗、润洗 | B.在通风橱中取用溴 |
| C.用pH试纸测得某氯水的pH为2 | D.用100 mL量筒取70.5 mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列装置和操作能达到实验目的的是( )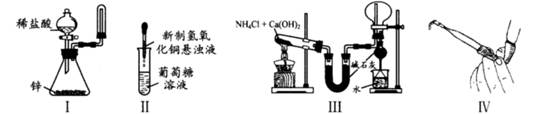
| A.实验I:制取并收集氢气 |
| B.实验II:验证葡萄糖的还原性 |
| C.实验III:实验室制氨气并收集干燥的氨气 |
| D.实验Ⅳ:检查碱式滴定管是否漏液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是
| A.可用稀盐酸代替稀硫酸 |
| B.量气管中液体为水 |
| C.反应完全后,冷却,读取量气管体积数,再减去所加硫酸的体积,即为生成的气体体积 |
| D.实验测得该试样中碳酸氢钠质量分数偏高,可能是测定气体体积时未冷却至室温 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S  Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为 ,
装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
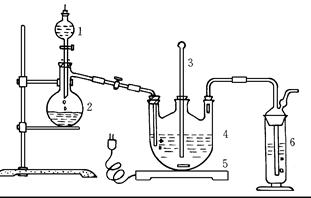
 Na2S2O3
Na2S2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com