
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+中碳原子的杂化方式为_________,CH3-的空间构型为_______。
(3) Na+和Ne互为等电子体,电离能I2(Na)______I1(Ne)(填“>”或“<”)。
(4)氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为__________,从原子结构分析影响ΔH2递变的因素为__________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
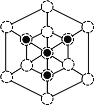
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子。已知晶胞中最近的B、P原子的距离为apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。(列出计算式即可,不必化简)
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置____。
画出B原子的投影位置____。

【答案】原子光谱 sp2 三角锥形 > HF的水溶液中存在氢键 原子半径 ![]()
 或
或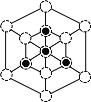
【解析】
(1)光谱分析中利用原子光谱上的特征谱线来鉴定元素;
(2)CH3+中的碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3;CH3-与NH3、H3O+互为等电子体,空间结构相似,据此分析解答;
(3)钠离子的正电性较强对核外电子的吸引力比氖更强,据此进行分析;
(4)HF分子间,以及HF与水分子间均能形成氢键,而其他卤化氢没有,故从溶液中分离出HF分子需要更多的能量;根据HF、HCl、HBr、HI中存在的卤素原子不同,结合原子结构的知识分析解答;
(5)①利用均摊法计算晶胞或者P、B原子数目,晶胞中最近的B、P原子的距离为晶胞体对角线的![]() ,据此计算晶胞的密度;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,据此作图。
,据此计算晶胞的密度;②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,据此作图。
(1)光谱分析中利用原子光谱上的特征谱线来鉴定元素,所以在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,故答案为:原子光谱;
(2)CH3+中的碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子采取sp2杂化;CH3-与NH3、H3O+均具有8个价电子、4个原子,互为等电子体,几何构型均为三角锥形,故答案为:sp2杂化;三角锥形;
(3)钠离子的正电性较强且半径较小,对核外电子的吸引力比氖原子更强,要想失去电子需要更多的能量,因此钠的第二电离能比氖的第一电离能更高,故答案为:>;
(4)HF分子与水分子、HF分子之间均存在氢键,而其他卤化氢没有,故从溶液中分离出HF分子需要更多的能量,导致ΔH1(HF)特别大;键能大小关系为:HF>HCl>HBr>HI,从原子结构方面分析,影响△H2递变的因素为卤素原子的原子半径的大小,故答案为:HF的水溶液中存在氢键;原子半径;
(5)①实心球为磷原子,处于晶胞顶点与面心,P做面心立方最密堆积;1个晶胞中,含有P原子数目为8×![]() +6×
+6×![]() =4个,含有B原子数目为4个,晶胞质量=
=4个,含有B原子数目为4个,晶胞质量=![]() g,设晶胞的棱长为x,已知晶胞中最近的B、P原子的距离为a pm,该距离为晶胞体对角线的
g,设晶胞的棱长为x,已知晶胞中最近的B、P原子的距离为a pm,该距离为晶胞体对角线的![]() ,则
,则![]() x=a pm= a×1010 cm,x=
x=a pm= a×1010 cm,x=![]() ×a×1010cm,晶体密度ρ=
×a×1010cm,晶体密度ρ=![]() =
=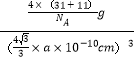 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() ;
;
②根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,六边形中形成两个倒立关系的正三角形,分别由3个B或者3个P形成,所以画图为: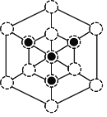 或
或 ,故答案为:
,故答案为: 或
或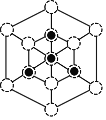 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上由乙苯生产苯乙烯的反应如下,有关说法正确的是
![]()
A. 该反应的类型为取代反应
B. 可用溴水鉴别乙苯和苯乙烯
C. 乙苯分子中所有原子可能在同一平面
D. 比乙苯多一个碳原子的同系物R的同分异构体(包含R)共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知: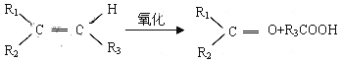
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个碳环共用两个或两个以上碳原子的一类多环脂环烃称为“桥环烃”,下图①和②是两种简单的桥环烃。下列说法正确的是

A. ①与2-丁烯互为同分异构体
B. ①和②的二氯代物均有4种
C. ②分子中所有碳原子处于同一平面内
D. 在一定条件下,①和②均能发生取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出如图中序号①~④仪器的名称:
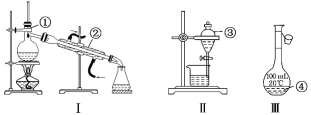
(1)①_____;②____;③_____;④_____。
(2)仪器①~④中,使用时必须检查是否漏水的有____(填仪器序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的CO2和O2,其分子数目之比为_____,原子数目之比为___,氧原子数目之比为____;质量相同的CO2和O2,其物质的量之比为____。
(2)4.8gO2和0.2 mol CO2,它们的物质的量之比是____,质量之比是____,在同温同压下的体积之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 4.6gC2H5OH与6.0gCH3COOH反应,生成的 CH3COOC2H3分子数目为0.1NA
B. 5.6gFe与足量水蒸气完全反应,转移的电子数目为0.2NA
C. 32gO2和O3的混合物中含有的氧原子数目为2NA
D. 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com