
【题目】现有10种元素的性质、数据如下表所列,它们均为短周期元素.
A | B | C | D | E | F | G | H | I | J | |
原子半径 (10﹣10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣2 |
回答下列问题:
(1)D在元素周期表中的位置_______,若H的一种同位素中子数为5,则其原子符号是_________,B元素的原子结构示意图是_________,G与F分别形成的简单离子半径大小关系为_________ 。
(2)F与A形成的化合物电子式是:_____________________。
(3)用电子式表示F2I的形成过程:_______________________________;
(4)F与J形成的化合物电子式为_____________,该化合物与水反应放出气体的化学方程式为__________________________。
【答案】 第三周期第VA族 ![]() B
B 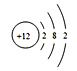 N3-> Na+
N3-> Na+ ![]() 、
、![]()
![]() Na+[:H]- NaH+H2O=NaOH+H2 ↑
Na+[:H]- NaH+H2O=NaOH+H2 ↑
【解析】试题分析:A元素主要化合价只有-2,所以A是O元素;C、F、J元素主要化合价只有+1,半径F>C>J,所以C是Li元素、F是Na元素、J是H元素;
D、G元素主要化合价只有+5、-3,半径D>G,所以D是P元素、G是N元素;I的主要化合价是+6、-2,I是S元素;E的主要化合价是+7、-1,E是Cl元素;B的主要化合价是+2,B是第ⅡA族元素,半径大于锂,所以B是第三周期,第ⅡA族元素,B是Mg元素;H的主要化合价是+3,H是第ⅢA族元素,半径小于磷,所以H是第二周期,第ⅢA族元素,H是B元素。
解析:根据以上分析,(1)D是P元素,在元素周期表中的位置第三周期第VA族,H是B元素,若H的一种同位素中子数为5,,质量数是10,则其原子符号是![]() B,B元素是Mg元素,原子结构示意图是
B,B元素是Mg元素,原子结构示意图是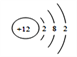 ,N3-与Na+电子层数相同,质子数N3-<Na+,离子半径大小关系为N3-> Na+ 。
,N3-与Na+电子层数相同,质子数N3-<Na+,离子半径大小关系为N3-> Na+ 。
(2)Na与O形成的化合物是过氧化钠和氧化钠,都是离子化合物,电子式是:![]() 、
、![]() 。
。
(3)Na2S是离子化合物,用电子式表示Na2S的形成过程:![]() ;
;
(4)Na与H形成的化合物是离子化合物,电子式为Na+[:H]- ,氢化钠与水反应放出氢气的化学方程式为NaH+H2O=NaOH+H2 ↑。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】某化学反应其△H=+122 kJ/mol,S=—231 J/(mol·K),下列说法正确的是( )
A. 在任何温度下都不能自发进行 B. 在任何温度下都能自发进行
C. 仅在高温下自发进行 D. 仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积 、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
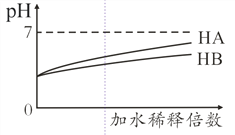
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)> c(A-)> c(H+) > c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是( )
A.Al(OH)3是某些胃药的一种成分
B.乳酸铁是某些补铁口服液的有效成分
C.臭氧可以作为新型自来水消毒剂
D.SO2常用作红葡萄酒中杀菌消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NO2的说法正确的是( )
A.NO2可由N2与O2反应直接制备
B.NO2有毒,但因其易溶于水且与水反应,因此不属于大气污染物
C.NO2既有氧化性也有还原性
D.NO2为红棕色气体,因此将NO2通入水中,溶液显红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)=2AB2(g)(A2、B2、AB2的结构式分别为 A===A、B—B、B—A—B),能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应的进行一定需要加热或点燃条件
B. 该反应若生成2molAB2(g)则放出的热量为 (E1-E2) kJ
C. 该反应断开化学键消耗的总能量大于形成化学键释放的总能量
D. 生成2 mol B—A键放出E2 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四位科学家都对原子结构的认识起到过重要的推动作用,其中首先提出原子核外的电子在一系列的轨道上运动的是( )
A. 汤姆生 B. 道尔顿 C. 波尔 D. 卢瑟福
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的过氧化物,具有强氧化性和漂白性。 通常可用作漂白剂和呼吸面具中的供氧剂。
(1)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞试液变红的原因___________________,依据实验现象推测红色褪去的原因是________________。
②加入MnO2反应的化学方程式为_______________________。
(2)实验小组两名同学共同设计如下装置探究过氧化钠与二氧化硫的反应。通入SO2,将带余烬的木条插入试管C中,木条复燃。

请回答下列问题:
甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:_________________________,检验反应后B中的白色固体含有Na2SO3的方法是:___________________________。
乙同学认为反应的后B中有Na2SO3还会有Na2SO4。乙同学猜想的理由是:______________________。
为检验产物中Na2SO4的存在乙同学设计并实施了如下实验方案:

甲同学认为该实验方案的现象不能证明有Na2SO4生成,其理由为_________________________。
③请补充完整实验小组测定B中反应完全后固体组成的实验方案。称取样品a 克加水溶解,__________,烘干,称量沉淀质量为b 克,计算含量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com