
【题目】常温下,等体积 、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
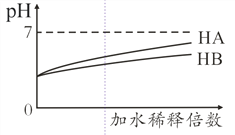
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)> c(A-)> c(H+) > c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
【答案】D
【解析】由图可知,等体积 、pH均为3的HA和HB溶液分别加水稀释后,HA的pH变化大,HB的pH变化小,则酸性HA>HB。A.HB溶液电离出的氢离子抑制水的电离,滴加NaOH溶液的过程中,氢离子浓度逐渐减小,水的电离程度逐渐增大,完全反应后,氢氧化钠电离的氢氧根离子抑制水的电离,随后水的电离程度又逐渐减小,故A错误;B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,由于碱和HB的相对强弱未知,最终,溶液可能显碱性、酸性、中性,故B错误;C. 根据电荷守恒,氨水与HA溶液混合后的溶液中存在:c(NH4+) +c(H+) = c(A-)+ c(OH-),因此c(NH4+)> c(A-)> c(H+) > c(OH-)不可能成立,故C错误;D. 等体积等pH的HA、HB两溶液中HB的物质的量大于HA,完全中和时,消耗同浓度NaOH溶液的体积:HA<HB,故D正确;故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用11.92gNaClO配成100mL溶液,向其中加入0.01mol Na2Sx恰好完全反应,生成Na2SO4和NaCl。
(1)NaClO溶液的物质的量浓度_________mol·L-1。
(2)化学式Na2Sx中的X=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上对血液中毒最常用的净化手段是血液透析。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透。血液中的蛋白质和血细胞不能透过透析膜,血液内的毒性物质则可以通过,由此可以判断( )
A.蛋白质、血细胞不溶于水,毒性物质可溶于水
B.蛋白质以分子形式存在,毒性物质以离子形式存在
C.蛋白质、血细胞的粒子直径大于毒性物质的粒子直径
D.蛋白质、血细胞不能透过滤纸,毒性物质能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于分散系和胶体的说法正确的是( )
A.胶体、溶液、浊液都是分散系 B.分散质粒子的半径:浊液>溶液>胶体
C.可见光通过溶液时,产生丁达尔现象 D.胶体都不透明,且稳定性极强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A. 收集氯气用排饱和食盐水的方法
B. 加压条件下有利于SO2和O2反应生成SO3
C. 将NO2球浸泡在热水中颜色加深
D. 加催化剂,使N2和H2在一定的条件下转化为NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋是一种常见的有机酸,其结构简式为:
![]()
(1)苹果醋中含有的官能团的名称是 ;
(2)苹果醋的分子式为 ;
(3)1 mol苹果醋与足量金属钠反应,能生成标准状况下的氢气 L;
(4)苹果醋可能发生的反应是 。
A.与NaOH溶液反应 B.与石蕊溶液作用
C.与乙酸在一定条件下酯化 D.与乙醇在一定条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有10种元素的性质、数据如下表所列,它们均为短周期元素.
A | B | C | D | E | F | G | H | I | J | |
原子半径 (10﹣10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣2 |
回答下列问题:
(1)D在元素周期表中的位置_______,若H的一种同位素中子数为5,则其原子符号是_________,B元素的原子结构示意图是_________,G与F分别形成的简单离子半径大小关系为_________ 。
(2)F与A形成的化合物电子式是:_____________________。
(3)用电子式表示F2I的形成过程:_______________________________;
(4)F与J形成的化合物电子式为_____________,该化合物与水反应放出气体的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校活动小组的同学拟用乙烯催化还原二氧化硫的方法来制取单质硫。
(1)甲组同学用乙醇脱水的反应来制取纯净的乙烯气体,其反应原理及制备装置如下:
主反应:C2H5OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
副反应:C2H5OH+2H2SO4(浓) ![]() C+2SO2↑+5H2O;
C+2SO2↑+5H2O;
C+H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
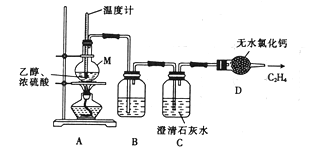
① 仪器M的名称是_______________。
② 装置B 中盛放的试剂可能是____________。
③ 装置C 的作用是______________
(2)乙组同学用甲组同学制得的乙烯并结合下列装置进行乙烯催化还原二氧化硫的实验。
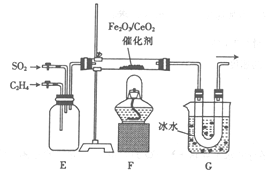
① 装置E的作用是___________;装置G的作用是_____________。
② 玻璃管中有硫及二氧化碳生成,该反应的化学方程式为_________。
③ 用下列装置检验G中逸出的气体含有氧化产物CO2。
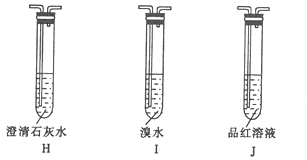
装置正确的连接顺序为G![]() _________,证明G中逸出的气体含有CO2的现象为_______。
_________,证明G中逸出的气体含有CO2的现象为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com