
下列说法中,正确的是
A.钢铁发生电化学腐蚀的正极反应式:Fe-2e— == Fe2+
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e—== 4OH—
C.电解饱和食盐水时,阳极的电极反应式为:2Cl — -2e—==Cl2 ↑
D.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- == Cu2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.若2H2(g)+O2(g) = 2H2O(g) ΔH= -483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1
B.原子弹爆炸是放热反应
C.若C(石墨,s) = C(金刚石,s) ΔH>0,则石墨能量低且键能小
D.由BaSO4(s) + 4C(s) = 4CO(g) + BaS(s) △H1 = +571.2kJ•mol-1 ①
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2 = +226.2kJ•mol-1 ②
可得反应C(s) + CO2(g) = 2CO(g) 的△H = +172.5kJ•mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是
A、SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO42-+Fe2++4H+
B、用两个铜电极电解CuSO4溶液:2Cu2++2H2O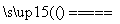 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C、NO2通入水中:3NO2+H2O===2H++2NO3—+NO
D、过量的CO2通入NaAlO2溶液中:2AlO2—+CO2+3H2O===2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图: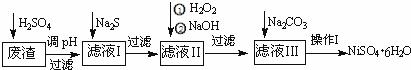
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
选用正确的试剂和分离方法,除去下列物质中所含少量杂质(括号内为杂质):
例: 乙醇(水)生石灰,蒸馏
(1)苯(苯酚) ;(2)甲烷(乙烯) ;(3)乙酸乙酯(乙酸) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.标准状况下,NA个SO3分子所占的体积约为22.4 L
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
D.标准状况下,22.4L Cl2与足量氢氧化钠溶液反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
反应 2A(g) + B(g)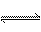 2C(g);△H > 0 。下列反应有利于生成C的是( )
2C(g);△H > 0 。下列反应有利于生成C的是( )
A. 低温、低压 B. 低温、高压 C. 高温、高压 D. 高温、低压
查看答案和解析>>
科目:高中化学 来源: 题型:
当溶液中XO42﹣ 和SO32﹣的离子数之比为1:2时,恰好完全发生氧化还原反应,X在还原产物中的化合价为( )
|
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com