
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | 6 | 8 | |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 |
|
| |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.
b. c.
c.  d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到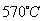 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将H2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将H2不断地通入 极,该电极反应式为 。
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
下图中每一个方框表示有关的一种反应物或生成物(部分生成物已省略),X是一种酸式盐,常用作化肥,加热分解生成A、B、C三种物质。其中A、C为无色气体,A能使澄清石灰水变浑浊,B在常温下是一种无色的液体。请填写下列空白:
(1)物质X的化学式是 ,
G的名称是 。
(2)X溶液与盐酸溶液反应的离子方程式是
。
(3)C→E的化学反应方程式是 。
(4)G与Cu反应的离子方程式是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g 水;
② 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的 ,
, ;
;
草酸( )的
)的 ,
,
③相同条件下电离出S2-的能力: ,以下离子方程式错误的是( )
,以下离子方程式错误的是( )
A.
B. 
C. 
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是短周期元素,其部分性质如下表
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的2/3 |
| Z | 第三周期原子半径最小的金属 |
下列说法正确的是
A.气态氢化物的热稳定性:X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.Z的氧化物中含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
关于离子键、共价键的各种叙述中正确的是( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.由不同元素组成的多原子分子里,一定只存在极性键
D.共价化合物分子中,一定不存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.常温下,淀粉遇I-变蓝色
B.油脂水解可得到氨基酸和甘油
C.所有烷烃和蛋白质中都只存在碳碳单键
D.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,由甲烷、甲醛(CH2O)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20% B.40% C.60% D.80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com