
已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g 水;
② 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的 ,
, ;
;
草酸( )的
)的 ,
,
③相同条件下电离出S2-的能力: ,以下离子方程式错误的是( )
,以下离子方程式错误的是( )
A.
B. 
C. 
D.
科目:高中化学 来源: 题型:
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式 ;Z的氢化物结构式为 ;写出U元素在周期表中的位置 。
(2)原子半径:U V(填>、<或=,下同);气态氢化物的水溶液的酸性:U V。
(3)写出UW2与V元素的单质在水溶液中反应的化学方程式是 。
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于 (填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是广泛应用于汽车、柴油机车等的启动电源。产生电能时的电极反应分别为:
Pb+SO42―–2e―=PbSO4 ①
PbO2+4H++SO42―+2e―=PbSO4+2H2O ②
下列有关铅蓄电池的说法不正确的是: ( )
A.①式表示负极反应,②式表示正极反应
B.铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低
C.铅蓄电池在放电时,电子从Pb通过导线流向PbO2
D.铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:
2NO2 (g) (红棕色)
 N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。
(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
(5)若反应达平衡状态时再升高温度,容器内混合气体颜色加深,则正反应是 反应。
(填“放热”或“吸热”。已知:降低温度有利于放热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | 6 | 8 | |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 |
|
| |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.
b. c.
c.  d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到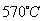 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将H2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将H2不断地通入 极,该电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(g)+5B(g)== 4C(g)+ 6D(g)在某密闭容器中进行,半分钟后,C的物质的量浓度增加了0.3mol/L。下列论述正确的是( )
A.半分钟内的平均反应速率:5v(B)=6v(D)
B.C的平均反应速率是0.010 mol·L-1·s-1
C.容器中含D的物质的量至少为0.45mol
D.容器中A的物质的量浓度增加了0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

(1)该反应的化学方程式为:
(2)反应开始至2min,用X表示的平均反应速率为:
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g)=2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“ 减小” 或“不变”)
① 降低温度:
②保持容器的体积不变,增加X(g)的物质的量:
③ 增大容器的体积:
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物分子中原子(或原子团)之间的相互影响会导致他们化学性质的改变。下列叙述能说明上述观点的是( )
A.等物质的量的乙二醇和乙醇分别与足量金属钠反应,乙二醇产生的氢气多
B.乙烯和苯都能和氢气发生加成反应
C.乙烯可发生加成反应,而乙烷不能
D.苯酚能与氢氧化钠溶液反应,而乙醇不能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com