
在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:
2NO2 (g) (红棕色)
 N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。
(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
(5)若反应达平衡状态时再升高温度,容器内混合气体颜色加深,则正反应是 反应。
(填“放热”或“吸热”。已知:降低温度有利于放热反应)
科目:高中化学 来源: 题型:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强。

(1) 写出X在周期表中的位置 。
(2)W的简单离子的还原性比Y简单离子的还原性 (填强或弱);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与W形成的化合物和Z单质水溶液反应,生成二种强酸,该反应的化学方程式是 。
(4)已知25℃时,2.3gC2H5OH(l)在足量的W单质充分反应后恢复原状,放出68.34kJ热量, 则该反应的热化学方程式:
 (5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
(5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.用SO2漂白纸浆和草帽辫
B.用酒精萃取碘水中的碘单质的操作,可选用分液漏斗,然后进行静置、分液
C.高温下用焦炭还原SiO2制取粗硅
D.除观察颜色差别外,区分氯化铁溶液与氢氧化铁胶体较简便的方法是丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.硒化氢是无色、有毒、比硫化氢稳定的气体
B.砹化银不溶于水也不溶于稀硝酸
C.硫酸镭是难溶于水的白色固体
D.锗单质是一种优良的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①相同温度下溶解度:MgCO3:0.02g/100g水,Mg(OH)2:0.0009g/100g 水;
② 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的 ,
, ;
;
草酸( )的
)的 ,
,
③相同条件下电离出S2-的能力: ,以下离子方程式错误的是( )
,以下离子方程式错误的是( )
A.
B. 
C. 
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为 |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个外成对电子; |
| ⑦H能形成红色(或砖红色)的 |
(1)G元素基态原子的价电子排布图为 。
(2)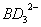 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测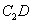 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5)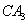 极易溶于
极易溶于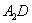 ,原因是 。
,原因是 。
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
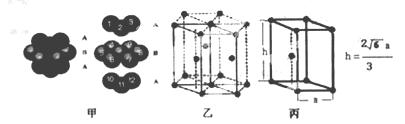
若已知E原子半径为r pm,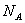 表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和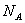 代数式表示)
代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2—>Z —
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是 ( )
|
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1mol维生素P可以和4mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com