
下列说法不正确的是 ( )
A.用SO2漂白纸浆和草帽辫
B.用酒精萃取碘水中的碘单质的操作,可选用分液漏斗,然后进行静置、分液
C.高温下用焦炭还原SiO2制取粗硅
D.除观察颜色差别外,区分氯化铁溶液与氢氧化铁胶体较简便的方法是丁达尔效应
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
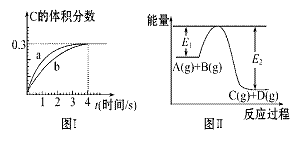
将1 mol A(g)和2 mol B(g)置于2 L某密闭容器中,在一定温度下发生反应:
A(g)+B(g) C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b
C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b
所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )
A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol·L-1·s-1
B.该温度下,反应的平衡常数数值约为7.36
C.恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行
D.在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2 B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.在多电子的原子里,能量高的电子通常在离核近的区域内运动
B.最外层电子数为8的微粒均是稀有气体元素的原子
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.在周期表中金属和非金属的分界线附近寻找制备半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,16g CH4含nA个H原子
B.1 mol Fe与足量稀HNO3反应,转移3nA个电子
C.0.1 mol/L NaHCO3溶液中含有0.1nA个Na+
D.常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式 ;Z的氢化物结构式为 ;写出U元素在周期表中的位置 。
(2)原子半径:U V(填>、<或=,下同);气态氢化物的水溶液的酸性:U V。
(3)写出UW2与V元素的单质在水溶液中反应的化学方程式是 。
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于 (填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的叙述,不正确的是( )
A.ⅡA族中无非金属元素 B.Ⅷ族中所含元素种类最多
C.0族中无金属元素 D.金属元素的种类比非金属元素多
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:
2NO2 (g) (红棕色)
 N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。
(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
(5)若反应达平衡状态时再升高温度,容器内混合气体颜色加深,则正反应是 反应。
(填“放热”或“吸热”。已知:降低温度有利于放热反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com