
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2 B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
两支试管中分别加入足量的等物质的量浓度的稀硫酸和氢氧化钠溶液,然后分别加入等质量的金属铝,充分反应,放出气体的体积比为
A.2︰3 B.3︰2 C.1︰3 D.1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是
A.该反应是放热反应 B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池则锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强。

(1) 写出X在周期表中的位置 。
(2)W的简单离子的还原性比Y简单离子的还原性 (填强或弱);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与W形成的化合物和Z单质水溶液反应,生成二种强酸,该反应的化学方程式是 。
(4)已知25℃时,2.3gC2H5OH(l)在足量的W单质充分反应后恢复原状,放出68.34kJ热量, 则该反应的热化学方程式:
 (5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
(5)已知N2(g)+2O2(g)===2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼( N2H4)与NO2完全反应生成氮气和气态水的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物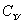 H3
H3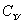 H===CH—
H===CH—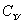 ≡CH中标有“·”的碳原子的杂化方式依次为 ( )
≡CH中标有“·”的碳原子的杂化方式依次为 ( )
A.sp、sp2、sp3 B.sp2、sp、sp3 C.sp3、sp2、sp D.sp3、sp、sp2
查看答案和解析>>
科目:高中化学 来源: 题型:
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位——“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如图,下列说法错误的是 ( )
A.多巴胺分子式为C8H11NO2。
B.多巴胺可以发生加成、取代、氧化反应。
C.和溴水反应时,1 mol多巴胺可以消耗6 mol溴单质。
D.多巴胺既可与强酸反应,又可以与强碱反应。

查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、 Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是 ,原因是 。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
XO(g)+ 1/2O2(g)====XO2(g) ΔH=-283.0 kJ·mol-1
T(s)+O2(g)=====TO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是______________________________。
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.用SO2漂白纸浆和草帽辫
B.用酒精萃取碘水中的碘单质的操作,可选用分液漏斗,然后进行静置、分液
C.高温下用焦炭还原SiO2制取粗硅
D.除观察颜色差别外,区分氯化铁溶液与氢氧化铁胶体较简便的方法是丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为 |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个外成对电子; |
| ⑦H能形成红色(或砖红色)的 |
(1)G元素基态原子的价电子排布图为 。
(2)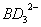 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测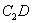 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5)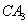 极易溶于
极易溶于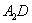 ,原因是 。
,原因是 。
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
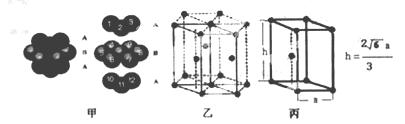
若已知E原子半径为r pm,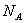 表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和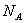 代数式表示)
代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com