
分析 (1)草酸的酸性比碳酸强,故草酸与碳酸氢钠反应生成二氧化碳,由于草酸足量,故生成NaHC2O4;
(2)2.52g草酸晶体(H2C2O4•2H2O)的物质的量为$\frac{2.52g}{126g/mol}$=0.02mol,NaOH的物质的量为0.1L×0.2mol/L=0.02mol,二者正好1:1反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度;A.根据电荷守恒判断;
B.根据物料守恒可知,溶液中草酸、醋酸根、草酸氢根的总浓度为0.2mol/L;
C.HC2O4-的电离程度大于其水解程度;
D.根据Na元素与C元素比例关系(物料守恒)判断;
(3)草酸被氧化为二氧化碳,把MnO4-还原为Mn2+,说明草酸具有还原性;
(4)乙烯与氯气发生加成反应生成ClCH2CH2Cl,再在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2CH2OH.
解答 解:(1)草酸的酸性比碳酸强,故草酸与碳酸氢钠反应生成二氧化碳,由于草酸足量,故还生成NaHC2O4,反应离子方程式为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,
故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)2.52g草酸晶体(H2C2O4•2H2O)的物质的量为$\frac{2.52g}{126g/mol}$=0.02mol,NaOH的物质的量为0.1L×0.2mol/L=0.02mol,二者正好1:1反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度.
A.根据电荷守恒:c(Na+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;
B.反应后的溶液为0.2mol/L NaHC2O4溶液,由物料守恒可知,溶液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)═0.2mol/L,故B错误;
C.HC2O4-的电离程度大于其水解程度,且电离程度不大,则溶液中c(HCO4-)>c( C2O42-)>c(H2C2O4),故C正确;
D.反应后的溶液为0.2mol/L NaHC2O4溶液,由钠元素与碳元素关系,可知溶液中c(Na+)═c(H2C2O4)+c( HC2O4-)+c(C2O42-),故D正确,
故选:CD;
(3)草酸被氧化为二氧化碳,把MnO4-还原为Mn2+,说明草酸具有还原性,反应离子方程式为:5H2C2O4+6H++2MO4-═2Mn2++10CO2↑+8H2O,
故答案为:还原性;5H2C2O4+6H++2MO4-═2Mn2++10CO2↑+8H2O;
(4)乙烯与氯气发生加成反应生成ClCH2CH2Cl,再在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2CH2OH,反应方程式为:CH2=CH2+Cl2→ClCH2CH2Cl、ClCH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaCl,
故答案为:CH2=CH2+Cl2→ClCH2CH2Cl、ClCH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaCl.
点评 本题比较综合,涉及离子方程式书写、微粒浓度比较、弱电解质的电离、氧化还原反应、有机物的合成等,属于拼合型题目,(1)为易错点,学生容易忽略草酸过量问题,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | GeO2不溶于NaOH溶液 | B. | 单质锗具有导电性 | ||
| C. | 锗易与盐酸反应放出H2 | D. | 锗是一种重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
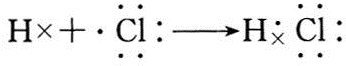 ;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程
;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程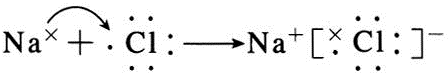 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | C | |
| B |
| A. | B为第二周期的元素 | B. | C为VA族元素 | ||
| C. | 三种元素都为非金属元素 | D. | B是化学性质最活泼的非金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 钯电极N为正极 | |
| B. | 钯电极M上发生氧化反应 | |
| C. | SCY陶瓷固体电解质中H+移向钯电极N | |
| D. | 电池总反应方程式为N2+3H2═2NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com