
【题目】CO2是重要的化工原料,也是应用广发的化工产品.CO2与过氧化钠或超氧化钾反应可产生氧气.
完成下列计算:
(1)CO2通入氨水生成NH4HCO3 , NH4HCO3很容易分解.2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为L(标准状况).
(2)某H2中含有2.40molCO2 , 该混合气体通入2.00L NaOH溶液中,CO2被完全吸收.如果NaOH完全反应,该NaOH溶液的浓度为 .
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9mol CO2在密封舱内和KO2反应后生成9mol O2 , 则反应前密封舱内H2O的量应该是多少?列式计算.
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O ![]() CO+3H2 , 已知:CO+2H2
CO+3H2 , 已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O。300mol CH4完全反应后的产物中,加入100mol CO2后合成甲醇.若获得甲醇350mol,残留氢气120mol,计算CO2的转化率.
CH3OH+H2O。300mol CH4完全反应后的产物中,加入100mol CO2后合成甲醇.若获得甲醇350mol,残留氢气120mol,计算CO2的转化率.
【答案】
(1)89.6
(2)2.4mol/L≥c≥1.2mol/L
(3)
设反应前密封舱内H2O的物质的量为n
4KO2+4CO2+2H2O→4KHCO3+3O2
2n n 1.5n
4KO2+2CO2→2K2CO3+3O2
9﹣2n 1.5(9﹣2n)
根据题意生成氧气9mol,所以有1.5n+1.5(9﹣2n)=9mol,解得n=3mol,即反应前密封舱内H2O的物质的量为3mol.
答:反应前密封舱内H2O的量应该是3mol。
(4)
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α,
CH4+H2O→CO+3H2
300mol 900mol
CO2+3H2→CH3OH+H2O
100amol 100amol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol﹣120mol,根据反应中氢元素的守恒可有900mol﹣120mol=350mol×2+100amol,
解得a=0.8,
即设CO2的转化率为80%,
答:CO2的转化率为80%.
【解析】(1)NH4HCO3完全分解生成NH3、CO2 , 方程式为NH4HCO3![]() NH3↑+CO2↑+H2O,分解后水为液态,则2molNH4HCO3可生成4mol气体,体积为4mol×22.4L/mol=89.6L,所以答案是:89.6;(2)2.40molCO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有, 假设全部生成生成NaHCO3 , 则发生CO2+NaOH=NaHCO3 , n(NaOH)= n(CO2)=2.40mol,则c(NaOH)=
NH3↑+CO2↑+H2O,分解后水为液态,则2molNH4HCO3可生成4mol气体,体积为4mol×22.4L/mol=89.6L,所以答案是:89.6;(2)2.40molCO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有, 假设全部生成生成NaHCO3 , 则发生CO2+NaOH=NaHCO3 , n(NaOH)= n(CO2)=2.40mol,则c(NaOH)= ![]() =1.20mol/L;假设全部生成,则发生CO2+2NaOH=Na2CO3 , n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=
=1.20mol/L;假设全部生成,则发生CO2+2NaOH=Na2CO3 , n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)= ![]() =2.40mol/L;
=2.40mol/L;
综合以上两种情况可知,NaOH溶液的浓度应该1.20mol/L≤c(NaOH)≤2.40mol/L.
所以答案是:2.4 mol/L≥c≥1.2 mol/L;
(3)可用两种方法解答:
方法一:依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2 , 即n(CO2):n(O2)=1:1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2
所以有n(H2O)=![]() n(CO2)=
n(CO2)= ![]() ×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol,
×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol,
方法二:设反应前密封舱内H2O的物质的量为n
4KO2+4CO2+2H2O→4KHCO3+3O2
2nn 1.5n
4KO2+2CO2→2K2CO3+3O2
9﹣2n 1.5(9﹣2n)
根据题意生成氧气9mol,所以有1.5n+1.5(9﹣2n)=9mol,解得n=3mol,即反应前密封舱内H2O的物质的量为3mol.
答:反应前密封舱内H2O的量应该是3mol;
(4)方法一:
CH4+H2O→CO+3H2
300mol 300mol 900mol
设CO2的转化率为α,CO的转化率为β
CO + 2H2 → CH3OH CO2 + 3H2 → CH3OH + H2O
300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol﹣﹣﹣﹣﹣﹣﹣①
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol﹣120mol,所以有
600βmol+300αmol=900mol﹣120mol﹣﹣﹣﹣﹣﹣﹣﹣②
由①②式可得α=0.8,即设CO2的转化率为80%.
方法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α,
CH4+H2O→CO+3H2
300mol 900mol
CO2+3H2→CH3OH+H2O
100amol 100amol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol﹣120mol,根据反应中氢元素的守恒可有900mol﹣120mol=350mol×2+100amol,
解得a=0.8,
即设CO2的转化率为80%,
答:CO2的转化率为80%.


科目:高中化学 来源: 题型:
【题目】称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1molNaOH的溶液,完全反应,生成NH3 1792ml(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
A.1:1
B.1:2
C.1.87:1
D.3.65:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、 .
(2)上述反应是否都是氧化还原反应(填“是”或“否”);写出反应①的化学方程式 .
(3)反应①后过滤的沉淀为 , 简述确定此物质中金属元素及其价态的操作过程 .
(4)利用铝制得的镁铝合金用途很广泛,比如用作手机机身,某课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数.过量盐酸
I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金 ![]() 溶液
溶液 ![]()
![]() 称量灼烧产物的质量.用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
称量灼烧产物的质量.用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:
当加入60~70ml氢氧化钠溶液时,请写出发生的离子方程式 . 你判断,根据图数轴中的数据能否求出合金中铝的质量分数?(选填“能”或“不能”).
下列①②两题选一题作答.(多答不给分)
①若不能求出合金中铝的质量分数,请说明理由.
②若能求出合金中铝的质量分数,则铝的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是聚合物胶黏剂、涂料等的单体,其一条合成路线如下(部分试剂及反应条件省略):
完成下列填空:
(1)反应①的反应类型是 . 反应④的反应条件是 .
(2)除催化氧化法外,由A得到 ![]() 所需试剂为 .
所需试剂为 .
(3)已知B能发生银镜反应.由反应②、反应③说明:在该条件下, .
(4)写出结构简式,C;M
(5)D与1﹣丁醇反应的产物与氯乙烯共聚可提高聚合物性能,写出该共聚物的结构简式.
(6)写出一种满足下列条件的丁醛的同分异构体的结构简式.等
①不含羰基②含有3种不同化学环境的氢原子
已知:双键碳上连有羟基的结构不稳定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某糕点主要由面粉、花生油和鸡蛋清焙制而成.下列说法正确的是( )
A.该糕点不含糖类物质
B.淀粉与葡萄糖互为同分异构体
C.淀粉、油脂和蛋白质都能水解
D.淀粉、油脂和蛋白质都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL﹣1 | 溶液的密度/gcm﹣3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |

(1)表中硫酸的质量分数为(不写单位,用含c1、ρ1 , 的代数式表示).
(2)物质的量浓度为c1molL﹣1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为molL﹣1 .
(3)将物质的量浓度分别为c2molL﹣1和 ![]() c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度
c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度 ![]() c2molL﹣1(设混合后溶液的体积变化忽略不计)
c2molL﹣1(设混合后溶液的体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备纳米颗粒Y的反应是3Fe2++2S2O32﹣+O2+XOH﹣═Y+S4O62﹣+2H2O,下列说法中,正确的是( )
A.Y的化学式为Fe2O3
B.x=6
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为 ![]() mol
mol
D.每生成1mol Y,反应转移的电子总数为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料.粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是粗盐提纯的操作流程.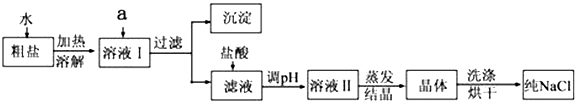
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液、稀盐酸.
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4 , 从提供的试剂中选出a所代表的试剂,试剂的选择和滴加顺序均正确的是:;
A.Na2CO3溶液、BaCl2溶液、NaOH溶液
B.溶液、NaOH溶液、K2CO3溶液
C.NaOH溶液、BaCl2溶液、Na2CO3溶液
D.Ba(NO3)2、NaOH溶液、Na2CO3溶液
E.BaCl2溶液、Na2CO3溶液、NaOH溶液
(2)过量碳酸盐溶液的作用是 .
(3)洗涤晶体操作使用的玻璃仪器有 .
(4)蒸发结晶的操作方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com