
【题目】丹参素的结构简式如下所示,有关它的说法错误的是( )
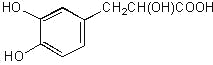
A. 1 mol丹参素能与3mol H2发生加成反应
B. 1 mol丹参素能与4mol NaOH发生反应
C. 能与NaHCO3、Na反应D. 可以发生酯化反应
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值为NA,下列说法中正确的是
A. 一定条件下3.2gSO2与足量O2反应转移电子数为0.1NA
B. 2.9g异丁烷和正丁烷混合物含有C-H键数目为0.5NA
C. 50mL12mol/L浓盐酸与足量MnO2共热转移电子数0.3NA
D. 标准状况下,3.36L三氯甲烷中含有氯原子0.45NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 油脂都不能使溴水褪色
B. 氨基酸是两性化合物,能与酸、碱反应生成盐
C. 福尔马林可用作食品防腐剂
D. 蔗糖和麦芽糖的水解产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率;
(3)2 min末SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
正极电极反应式为______________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu===2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为_____________,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为_____________g。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______________。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的总反应化学方程式是:________________。
②电池工作一段时间后硫酸溶液的浓度_____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2===2H2O,负极反应为H2+CO![]() -2e-===CO2↑+H2O,则下列推断正确的是( )
-2e-===CO2↑+H2O,则下列推断正确的是( )
A.电池工作时,CO![]() 向负极移动
向负极移动
B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极
C.正极的电极反应式为4OH--2e-===O2↑+2H2O
D.通氧气的电极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到限度的标志是( )
2AB(g)达到限度的标志是( )
A. 单位时间内生成n mol A2同时生成n mol AB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
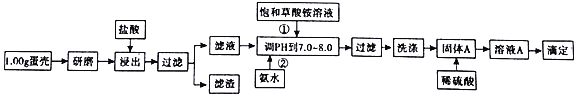
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是______________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_________。
(3)洗涤固体A最好选用“冰水”洗涤,其目的是___________。
(4)在一定温度下,向2L的密闭容器中放人足量的草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)![]() CaO(s)+CO(g)+CO2(g)若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
CaO(s)+CO(g)+CO2(g)若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
(5)用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。
步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mI。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2=20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4=20.80 |
①滴定终点的现象是______________________。
②该蛋壳中CaCO3的质量分数=______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com