
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
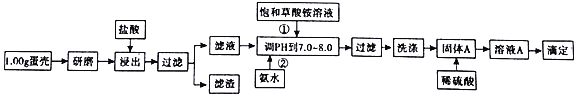
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是______________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_________。
(3)洗涤固体A最好选用“冰水”洗涤,其目的是___________。
(4)在一定温度下,向2L的密闭容器中放人足量的草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)![]() CaO(s)+CO(g)+CO2(g)若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
CaO(s)+CO(g)+CO2(g)若前5min内生成CaO的质量为l1.2g,则该段时间内v(CO)=_________。
(5)用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。
步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1mI。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2=20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4=20.80 |
①滴定终点的现象是______________________。
②该蛋壳中CaCO3的质量分数=______%,则此法求得的钙含量_____实际值(填“>”“=”或“<”)。
【答案】 SiO2 保持较大的C2O42-浓度,使Ca2+沉淀完全 (合理答案均可给分) 减少草酸钙固体的溶解 0.02 mol·L-1·min-1 当加入最后1滴高锰酸钾溶液时,溶液颜色由无色变成浅红色,且30 s内不褪色 95.00 >
【解析】(1)样品中SiO2与盐酸不反应,所以得到的滤渣为SiO2。(2)C2O42-+H+![]() HC2O4-,HC2O4-+H+
HC2O4-,HC2O4-+H+![]() H2C2O4,在碱性条件下,上述平衡逆向移动,C2O42-的浓度增大,有利于Ca2+沉淀完全,故答案为:保持较大的C2O42-浓度,使Ca2+沉淀完全。(3)CaC2O4(s)
H2C2O4,在碱性条件下,上述平衡逆向移动,C2O42-的浓度增大,有利于Ca2+沉淀完全,故答案为:保持较大的C2O42-浓度,使Ca2+沉淀完全。(3)CaC2O4(s)![]() Ca2+(aq)+C2O42-(aq),用0. lmol·L-1草酸铵溶液洗涤,C2O42-浓度增大,可以使上述溶解平衡逆向移动,从而减少CaC2O4固体的溶解。(4)CaO的物质的量=11.2g/56g·mol-1=0.2mol,所以生成的CO的物质的量也为0.2mol,v(CO)=0.2mol÷2L÷5min=0.02 mol·L-1·min-1 。(5)①KMnO4具有强氧化性,草酸具有还原性,两者发生氧化还原反应,离子方程式为: 2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O 。②高锰酸钾溶液呈紫红色,加入到草酸溶液中时紫红色褪去,混合溶液显无色,当滴定完成时再滴入一滴高锰酸钾溶液,溶液将会由无色变成紫红色,且30s内不褪色,即可说明滴定已经达到终点。③第4次滴定时高锰酸钾溶液的体积与前3次的体积相差较大,说明第4次滴定误差较大,舍去这组数据,滴定时平均消耗的高锰酸钾溶液的体积为(20.02+20.00+19.98)÷3ml=20.00ml,所以消耗的高锰酸钾的物质的量为20.00×10-3L×0.0190 mol·L-1=3.8×10-4mol,根据2MnO4-+6H++5H2C2O4
Ca2+(aq)+C2O42-(aq),用0. lmol·L-1草酸铵溶液洗涤,C2O42-浓度增大,可以使上述溶解平衡逆向移动,从而减少CaC2O4固体的溶解。(4)CaO的物质的量=11.2g/56g·mol-1=0.2mol,所以生成的CO的物质的量也为0.2mol,v(CO)=0.2mol÷2L÷5min=0.02 mol·L-1·min-1 。(5)①KMnO4具有强氧化性,草酸具有还原性,两者发生氧化还原反应,离子方程式为: 2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O 。②高锰酸钾溶液呈紫红色,加入到草酸溶液中时紫红色褪去,混合溶液显无色,当滴定完成时再滴入一滴高锰酸钾溶液,溶液将会由无色变成紫红色,且30s内不褪色,即可说明滴定已经达到终点。③第4次滴定时高锰酸钾溶液的体积与前3次的体积相差较大,说明第4次滴定误差较大,舍去这组数据,滴定时平均消耗的高锰酸钾溶液的体积为(20.02+20.00+19.98)÷3ml=20.00ml,所以消耗的高锰酸钾的物质的量为20.00×10-3L×0.0190 mol·L-1=3.8×10-4mol,根据2MnO4-+6H++5H2C2O4![]() 2Mn2++10CO2↑+8H2O可知草酸的物质的量为2.5×3.8×10-4mol=9.5×10-4mol,故草酸钙的物质的量也为9.5×10-4mol,从而碳酸钙的物质的量也为9.5×10-4mol,求得碳酸钙的质量为9.5×10-4mol×100g·mol-1=9.5×10-2g,以上的数据都是根据25ml溶液A计算的,所以250ml溶液A中含有碳酸钙的质量为9.5×10-2g×10=0.95g,故CaCO3的质量分数=0.95g/1.0g×100%=95%;因为在生成草酸钙沉淀的同时也会生成草酸镁沉淀,导致得到的固体A中含有草酸镁,而使A溶液中草酸的量增大,消耗的高锰酸钾溶液的体积偏大,故此法求得的钙含量大于实际值。
2Mn2++10CO2↑+8H2O可知草酸的物质的量为2.5×3.8×10-4mol=9.5×10-4mol,故草酸钙的物质的量也为9.5×10-4mol,从而碳酸钙的物质的量也为9.5×10-4mol,求得碳酸钙的质量为9.5×10-4mol×100g·mol-1=9.5×10-2g,以上的数据都是根据25ml溶液A计算的,所以250ml溶液A中含有碳酸钙的质量为9.5×10-2g×10=0.95g,故CaCO3的质量分数=0.95g/1.0g×100%=95%;因为在生成草酸钙沉淀的同时也会生成草酸镁沉淀,导致得到的固体A中含有草酸镁,而使A溶液中草酸的量增大,消耗的高锰酸钾溶液的体积偏大,故此法求得的钙含量大于实际值。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】丹参素的结构简式如下所示,有关它的说法错误的是( )
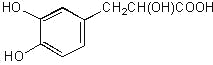
A. 1 mol丹参素能与3mol H2发生加成反应
B. 1 mol丹参素能与4mol NaOH发生反应
C. 能与NaHCO3、Na反应D. 可以发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 稀硝酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-=NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
D. HS-的电离:HS-+H2O![]() OH-+HS-
OH-+HS-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
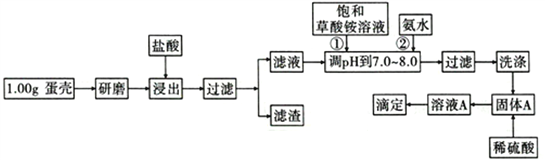
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________________________________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________________。
(3)洗涤最好选用_____(填“冰水”或“0. lmol/L草酸铵溶液”),其目的是____________________。
(4)在一定温度下,向2L的密闭容器中放入足量的草酸钙(固体所占体积忽略不计)发生反应: CaC204(s) ![]() CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
(5)滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。 步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消粍KMnO4溶液V1mL。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol /L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2= 20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4 = 20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为____________________。
②滴定终点的现象是________________________________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_________实际值(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硫酸反应后试管底部有白色固体并有少量黑色物质。倒去上层浓硫酸,将剩余固体(含少量硫酸)倒入盛水的烧杯中,所得溶液为蓝色,仍有黑色固体未溶。试回答:
(1)原试管底部的白色固体是________,形成白色固体的原因是_________________________。
(2)黑色固体可能是CuO吗?说明理由:___________________________________。
(3)资料显示,CuS、Cu2S为黑色固体,CuS、Cu2S都能被硝酸氧化为Cu2+和SO![]() ,都能在空气中灼烧生成CuO和SO2。
,都能在空气中灼烧生成CuO和SO2。
①写出CuS溶于浓硝酸的化学方程式:_________________________。
②将烧杯中黑色固体过滤并洗涤干净,加入少量浓硝酸,待固体溶解后再加入少量BaCl2溶液。该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
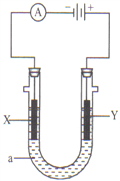
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时, 同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是:______________;在X极附近观察到的现象是:__________________。
②Y电极上的电极反应式是:_____________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_____;
②Y电极的电极反应式是_____________________。(不考虑杂质反应)
(3)若要在铁钉表面镀铜,X电极的材料是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 .能证明该阴离子是否存在的简单实验操作为____ __.
(2)用离子方程表达下列反应:
①中生成气体A: .②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl﹣)为 mol/L.(若有些离子不存在,请填0mol/L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com