
【题目】下列物质中,不与SiO2反应的是
A. 氢氟酸 B. 烧碱
C. 硝酸 D. 生石灰
科目:高中化学 来源: 题型:
【题目】下图是2SO2(g) + O2(g) = 2SO3(g)反应过程中的能量变化, 已知1mol SO2(g)完全氧化为1mol SO3的ΔH= —99kJ·mol-1,请回答下列问题:
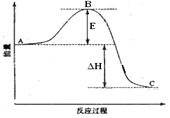
(1)图中A、C分别表的物质是__________________、________________,E的大小对该反应的焓变有无影响?___________(填“有”或“无”)(该反应通常用V2O5作催化剂,加V2O5会使图中B点降低。);
(2)图中△H = _____________kJ·mol-1;
(3)已知:S(s) + O2(g) = SO2(g) ΔH=-296 kJ·mol-1,计算由3 mol S(s)与氧气反应生成3 molSO3(g)的△H = ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是:( )
A. 元素周期表有8个主族
B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期
D. 短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )
A.煤经过气化和液化两个物理变化,可变为清洁能源
B.汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一
C.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
D.糖类、油脂和蛋白质都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
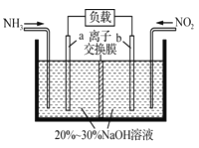
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
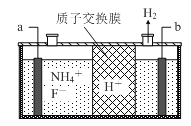
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
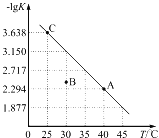
A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B. 如图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则HB是强酸
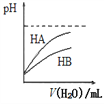
C. 25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D. 某吸热反应能自发进行,则该反应一定是熵增的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl36H2O晶体.(图中夹持及尾气处理装置均已略去) 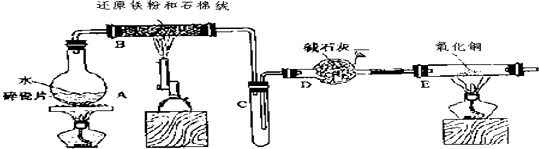
(1)烧瓶底部放置了几片碎瓷片,
碎瓷片的作用是
装置B中发生反应的化学方程式是 .
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,
装置E中的现象是 .
(3)停止反应,待B管冷却后,取其中的固体,加入过量盐酸充分反应,过滤.简述检验滤液中Fe3+的操作方法 .
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如下:
滤液 ![]() FeCl3溶液
FeCl3溶液 ![]() FeCl36H2O晶体
FeCl36H2O晶体
步骤中通入Cl2的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据比较,前者比后者小的是
A.氯水与氨水中微粒种类B.乙烷与苯分子中碳碳键键长
C.氯化铯与氯化钠的熔点D.Al2O3与AlCl3的熔点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com