
有关钴和铁化合物的性质见下表:
|
化学式 |
溶度积(室温时)Ksp |
沉淀完全时的pH |
氯化钴晶体的性质 |
|
Co(OH) 2 |
5.9×10-15 |
9.4 |
CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
|
Fe(OH) 2 |
1.6×10-14 |
9.6 |
|
|
Fe(OH) 3 |
1.0×10-35 |
x |
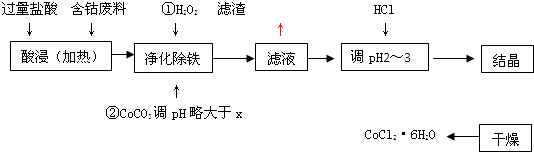
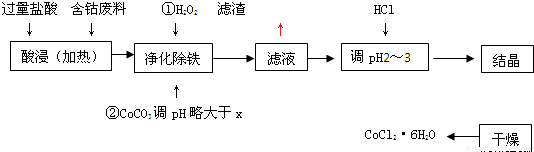
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑工艺流程如下:
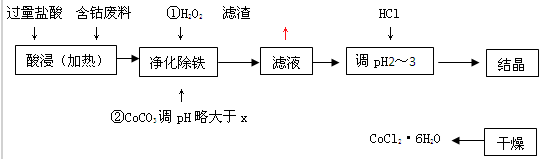
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全。试计算室温下,Fe(OH) 3沉淀完全时,则x= 。
(3)②步中用CoCO3调pH略大于x的原因是 。
(4)滤液中所含溶质有 , 。
(5)为了防止CoCl2·6H2O脱水,“干燥”时宜采用的方法或操作是 , 。
(1)CoCO3+2H+=Co2++H2O+CO2↑
(2)4
(3)使Fe3+完全沉淀
(4)CoCl2
(5)减压或温度低于110℃或在HCl气流中加热(任写2点)
【解析】
试题分析:(1)“净化除铁”中,加入CoCO3(难溶),CoCO3属于碳酸盐,可与酸反应,CoCO3+2H+=Co2++H2O+CO2↑,通过此反应降低溶液的酸性,调溶液的pH,答案为:CoCO3+2H+=Co2++H2O+CO2↑;
(2)滤液中(Fe3+)≤1.0×10-5mol·L-1时,可视为Fe3+沉淀完全,Ksp[Fe(OH)3 ]=1.0×10-35=c(Fe3+)×c3(OH-)=1.0×10-5mol·L-1×c3(OH-),所以c(OH-)=10-10mol·L-1,c(H+)=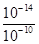 mol·L-1=10-4mol·L-1,PH=-lgc(H+)=-lg10-4=4;答案为:4;
mol·L-1=10-4mol·L-1,PH=-lgc(H+)=-lg10-4=4;答案为:4;
(3)根据(2)分析可知,为了使Fe3+完全沉淀,pH应略大于4,答案为:使Fe3+完全沉淀;
(4)除去Fe3+,滤液中主要含有NaCl、CoCl2、以及极少量的HCl,答案为:CoCl2;NaCl;
(5)因CoCl2·6H2O在110°C~120°C时脱水变成蓝色无水氯化钴,所以不能用高温烘干,为了防止CoCl2·6H2O脱水,“干燥”时宜采用的方法或操作是减压或温度低于110℃或在HCl气流中加热,答案为:减压或温度低于110℃;或在HCl气流中加热.
考点:物质分离和提纯的方法和基本操作综合应用


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
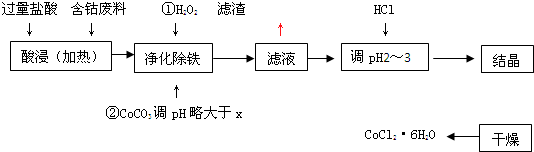
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
查看答案和解析>>
科目:高中化学 来源:广东省深圳市2011届高三二模理综化学试题 题型:022
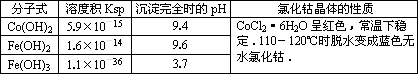
有关钴和铁化合物的性质见下表
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑.工艺流程如下:
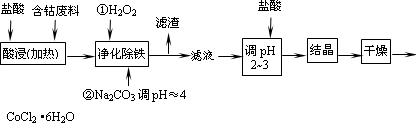
试回答:
(1)“净化除铁”中,写出加入H2O2
时反应的离子方程式________.(2)②步中用Na2CO3调pH≈4的原因是________________.
(3)“滤液”中所含主要溶质的化学式是________.
(4)为防止CoCl2·6H2O脱水,“干燥”时可采用的方法或操作是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省福州八县(市)一中高二(上)期末化学试卷(解析版) 题型:解答题
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com