
【题目】一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是
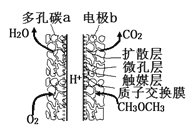
A. 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极
B. 电极b上发生的反应为:CH3OCH3-12e-+3H2O=2CO2+12H+
C. H+由b电极向a电极迁移
D. 二甲醚直接燃料电池能量密度( kW·h·kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍
【答案】A
【解析】A、采用多孔导电材料,可以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,而该极是氧气放电,所以是正极,而不是负极,A错误;B、电极b是负极发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+,B正确;C、阳离子向正极移动,所以H+由b电极向a电极迁移,C正确;D、二甲醚提供1mol电子所需质量为:46/12g,而甲醇(CH3OH)提供1mol电子所需质量为:30/6g,所以二甲醚直接燃料电池能量密度( kWhkg-1)约为甲醇(CH3OH)直接燃料电池能量密度为:5÷(46/12)约为1.4倍,D正确;答案选A。


科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):
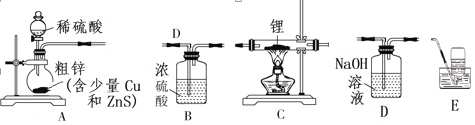
(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。
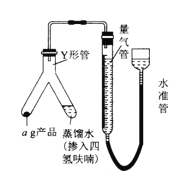
(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化加氢可生成 3-甲基己烷的是( )
A.CH2=CHCH(CH3)CH2CH2CH3
B.CH2=C(CH3)CH2CH2CH2CH3
C.CH3C(CH2CH3)=CHCH3
D.CH3CH2CH2C(CH3)=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素金属性、非金属性强弱判断不正确的是( )
A. 高温下2C+SiO2![]() 2CO↑+Si,说明非金属性:C>Si
2CO↑+Si,说明非金属性:C>Si
B. 碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C. 氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D. 氧化性:Cu2+>Na+,说明金属性:Na>Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p | |||||||||||||||
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式:____。
(2)c与a形成6个原子组成分子结构简式:__________,该分子是:_______(填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是__________________________;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
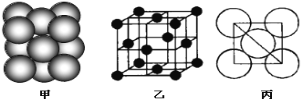
晶胞中i原子的配位数为___________,一个晶胞中i原子的数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如下图,下列说法正确的是( )

A. 脱硝的总反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
B. NH3催化还原NO为吸热反应
C. 过程1中NH3断裂非极性键
D. 过程中NO为氧化剂,Fe2+为还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:(A、B均为气体)
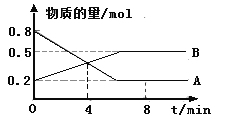
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ;
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
(2)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线Ⅱ所示。a,b,c,d,e括号内数据表示坐标.
CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线Ⅱ所示。a,b,c,d,e括号内数据表示坐标.
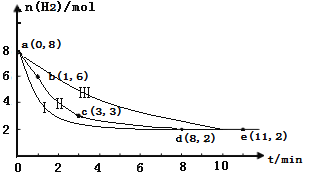
①a—b,b—c,c—d,d—e四段中,平均反应速率最大的时间段是___________ ,该时间段内CO2的平均反应速率是________。
②若在反应中加入了催化剂,则反应过程将变为图中的曲线_____ (填“Ⅰ”或“Ⅱ”或“Ⅲ”)。
③平衡时CO2的转化率是_________;反应前后容器内的压强比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgI胶体微粒能吸附I-。在10mL0.01mol·L-1KI溶液中,滴入8~10滴(1滴约0.1mL)0.01mol·L-1AgNO3溶液后,将溶液装入半透膜袋中并浸泡在蒸馏水里,过一段时间后,水中含有数目最多的离子是
A.K+B.K+、NO3-C.I-D.Ag+、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com