
【题目】将1.60gCuSO4固体在高温下加热,得到0.72g红色固体(纯净物,不含S元素),同时有气体X生成,X可能是SO2、SO3、O2中的两种或三种。下列说法正确的是
A.所得红色固体是铜
B.将X通入氢氧化钡溶液,若溶液变浑浊,则X中含有SO3
C.X的物质的量最少为0.01mol
D.将X缓慢通过足量NaOH溶液,若溶液增重0.72g,则X中含0.005molO2
【答案】D
【解析】
A. 1.6g硫酸铜即0.01mol硫酸铜,铜元素的质量应为0.01mol×64g/mol=0.64g<0.72g,又知剩余固体为不含硫元素的纯净物,且剩余固体为红色,可知剩余红色固体为Cu2O,故A错误;
B. 将X通入氢氧化钡溶液,SO2与水反应生成的亚硫酸可能被O2氧化成硫酸,也能生成硫酸钡沉淀,若溶液变浑浊,不能说明X中含有SO3,故B错误;
C. 1.6g硫酸铜即0.01mol硫酸铜,硫元素的物质的量为0.01mol,其在高温下分解,若气态物质为SO3和O2,则由元素守恒可知n(SO3)=0.01mol,把0.01mol二价铜氧化成正一价铜转移0.01mol电子,需要氧元素的物质的量为0.01mol×![]() =0.0025mol,X的物质的量n=n(SO3)+n(O2)=0.01 mol+0.0025=0.0125 mol,此时物质的量最少,若气态产物为SO2和O2,即SO3在高温下分解,此时气体物质的量最多,故C错误;
=0.0025mol,X的物质的量n=n(SO3)+n(O2)=0.01 mol+0.0025=0.0125 mol,此时物质的量最少,若气态产物为SO2和O2,即SO3在高温下分解,此时气体物质的量最多,故C错误;
D. 将X缓慢通过足量NaOH溶液,含硫气体完全被氢氧化钠溶液吸收,若溶液增重0.72g,则X中的含硫气体质量为0.72g,由质量守恒m(O2)=1.6g-0.73g-0.72g=0.16g,算出O2的物质的量为0.005mol,故D正确;


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
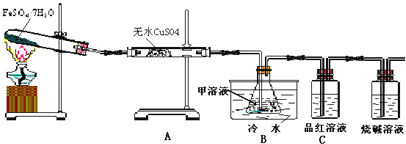
(1)用于检验SO2气体的装置是______(填装置的字母),确认水蒸气存在的现象是______;
(2)利用装置B可以确认的产物是______,装置B中的甲溶液可选(填序号)______。
①足量澄清石灰水②足量氯化钡溶液③足量硝酸钡溶液
该装置中冷水的作用是______;
(3)为探究Fe2O3的性质和用途,取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为______,检验该分散系最简方法的操作为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
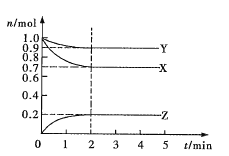
(1)该反应的化学方程式为______________。
(2)反应开始至2min,用Z表示的平均反应速率为_________。
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗![]() X,同时生成
X,同时生成![]() Z
Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。
(2)Fe的基态原子有________个未成对电子,Fe3+的电子排布式为__________________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为__________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1mol乙醛分子中含有的σ键的数目为__________。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度_________________________________________________g/cm3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的还原产物是______;
(2)该反应的平衡常数表达式为K=____________;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);若已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,则N2消耗速率为
(CO)=18molL﹣1min﹣1,则N2消耗速率为![]() (N2)=_________;
(N2)=_________;
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
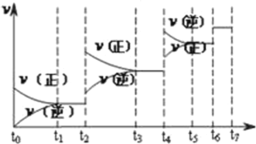
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:![]() 十
十![]() ,达到平衡时C的浓度为
,达到平衡时C的浓度为![]() 若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为
若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍为![]() 的是
的是![]()
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com