
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的还原产物是______;
(2)该反应的平衡常数表达式为K=____________;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);若已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,则N2消耗速率为
(CO)=18molL﹣1min﹣1,则N2消耗速率为![]() (N2)=_________;
(N2)=_________;
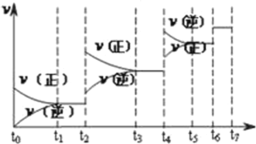
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
【答案】Si3N4 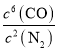 < 减小 6 molL﹣1min﹣1 升高温度或增大压强 t3-t4
< 减小 6 molL﹣1min﹣1 升高温度或增大压强 t3-t4
【解析】
(1) 反应中N元素的化合价降低,由0价降为-3价,则氧化剂为氮气,氧化剂对应的生成物为还原产物,还原产物为Si3N4;
(2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K= ;
;
(3) 该反应为放热反应,△H<0;升高温度平衡向逆反应方向移动,则平衡常数减小,速率之比等于化学计量数之比,则![]() ,已知CO生成速率为
,已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,
(CO)=18molL﹣1min﹣1,![]() (N2)= 6molL﹣1min﹣1;
(N2)= 6molL﹣1min﹣1;
(4) t4时正逆反应速率都较原平衡时的速率大,且平衡向逆反应方向移动,可升高温度或增大压强;t2~t3平衡正向移动,t3~t4保持平衡状态,在t4~t5反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高;
故答案为:升高温度或增大压强;t3~t4。


科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通干电池,是一种广泛使用的可移动化学电源,其结构如图甲所示,电池反应是:![]() 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
实验一、用废锌制取防腐剂皓矾![]() 图乙
图乙![]()
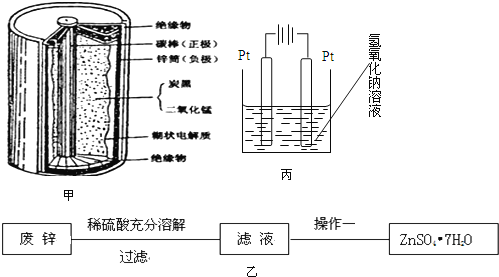
![]() 操作一的名称是:______。
操作一的名称是:______。
![]() 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物![]() 四羟基锌酸钠
四羟基锌酸钠![]() 和
和![]() ,该配合物中心离子是______,配位数是 ______。
,该配合物中心离子是______,配位数是 ______。
实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
![]() 灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物
灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物![]() 和
和![]() 。
。
![]() 写出
写出![]() 与浓盐酸反应的离子方程式: ______ 。
与浓盐酸反应的离子方程式: ______ 。
![]() 取
取![]() 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气![]() ,则混合物中
,则混合物中![]() 和
和![]() 质量之比是: ______ 。
质量之比是: ______ 。
实验三、查询资料得知,还可以通过电解的方式,将![]() 转化为
转化为![]() ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置![]() 图丙
图丙![]() ,将混合物粉末调成糊状,附在其中的 ______ 边电极上
,将混合物粉末调成糊状,附在其中的 ______ 边电极上![]() 填左或者右
填左或者右![]() ,该电极上发生的电极反应式是: ______
,该电极上发生的电极反应式是: ______ ![]() 在电解过程中溶液的pH将 ______填变大、变小、不变
在电解过程中溶液的pH将 ______填变大、变小、不变![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.60gCuSO4固体在高温下加热,得到0.72g红色固体(纯净物,不含S元素),同时有气体X生成,X可能是SO2、SO3、O2中的两种或三种。下列说法正确的是
A.所得红色固体是铜
B.将X通入氢氧化钡溶液,若溶液变浑浊,则X中含有SO3
C.X的物质的量最少为0.01mol
D.将X缓慢通过足量NaOH溶液,若溶液增重0.72g,则X中含0.005molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)铁晶体有两种晶胞,如图1、图2所示。
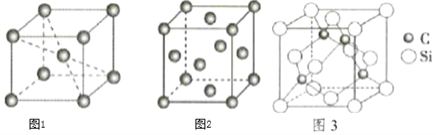
图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石![]() 碳化硅
碳化硅![]() 晶体硅
晶体硅
C.晶格能由大到小:NaF>NaCl>NaBr>NaI
D.熔点由高到低:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置,A、B和C是中学常见的化合物,回答问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)上述所列元素中,最高价氧化物的水化物的酸性最强的是________(填化学式)。
(2)②元素最高正价与④元素形成的化合物的电子式是__________。
(3)⑤⑨两种元素形成氢化物的水溶液的酸性由弱到强的顺序为________(用化学式表示)。
(4)从④⑥两种元素形成的化合物与④⑧两种元素形成的化合物的混合物中分离提纯④⑧两种元素形成的化合物,可加入上表中________(用元素符号表示)两种元素形成的化合物的水溶液后,再过滤洗涤。
(5)③元素的气态氢化物与其最高价氧化物的水化物反应生成的物质为________(用化学式表示),该物质所含化学键类型有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com