
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)铁晶体有两种晶胞,如图1、图2所示。
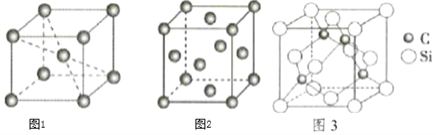
图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
【答案】![]()
![]()
![]()
![]()
![]()
![]() 或CO 12
或CO 12 ![]() 杂化转化为
杂化转化为![]() 杂化 小
杂化 小 ![]() 面心立方最密堆积
面心立方最密堆积 
【解析】
(1)根据铁原子的价层电子排布式、泡利原理和洪特规则即可画出轨道表达式;
(2)同主族自上而下原子半径逐渐增大,第一电离能逐渐减小;原子晶体的熔沸点大于分子晶体;键长越短,键能越大,据此分析作答;
(3)等电子体可采用替换法进行解答;配位键也属于![]() 键,
键,![]() 中
中![]() 与
与![]() 形成6个配位键,即6个
形成6个配位键,即6个![]() 键,而
键,而![]() 中有1个
中有1个![]() 键,一共有6个
键,一共有6个![]() ,据此可算出
,据此可算出![]() 键的总键数;
键的总键数;
(4)CH4为正四面体结构,C原子采取![]() 杂化,键角为
杂化,键角为![]() ,
,![]() 为平面结构,C原子采取
为平面结构,C原子采取![]() 杂化,键角为
杂化,键角为![]() ,
,![]() 分子中1s与1s电云重叠形成
分子中1s与1s电云重叠形成![]() 键, 据此分析作答;
键, 据此分析作答;
(5)图1属于体心立方堆积,Fe原子配位数为8;图2中Fe原子处于面心、顶点,属于面心立方最密堆积,据此分析;
(6)C原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线处于晶胞体对角线上,距离等于晶胞体对角线长度的![]() ,而晶胞体对角线长度等于晶胞棱长的
,而晶胞体对角线长度等于晶胞棱长的![]() 倍,晶胞中C原子数目
倍,晶胞中C原子数目![]() 、Si原子数目
、Si原子数目![]() ,晶胞质量
,晶胞质量![]() ,根据晶胞的质量和密度可计算出晶胞的体积和晶胞的棱长,进而算出碳化硅晶体内碳硅键的键长,据此分析解答;
,根据晶胞的质量和密度可计算出晶胞的体积和晶胞的棱长,进而算出碳化硅晶体内碳硅键的键长,据此分析解答;
(1)基态铁原子的价层电子排布式为![]() ,由泡利原理、洪特规则,轨道表达式为:
,由泡利原理、洪特规则,轨道表达式为:![]() ;
;
故答案为:![]() ;
;
(2)①同主族自上而下原子半径增大,故原子半径:![]() ;
;
故答案为:![]() ;
;
②同主族自上而下第一电离能减小,故第一电离能:![]() ;
;
故答案为:![]() ;
;
③CO2属于分子晶体,而![]() 属于原子晶体,故熔点:
属于原子晶体,故熔点:![]() ;
;
故答案为:![]() ;
;
④C-H的键长比![]() 键的短,故键能:
键的短,故键能:![]() ;
;
故答案为:![]() ;
;
![]() 用N原子替换C原子与1个单位负电荷,或者用O原子替换N原子与1个单位负电荷,得到与
用N原子替换C原子与1个单位负电荷,或者用O原子替换N原子与1个单位负电荷,得到与![]() 互为等电子体的分子为:
互为等电子体的分子为:![]() 或CO;
或CO;![]() 中
中![]() 与
与![]() 形成6个配位键,
形成6个配位键,![]() 中有1个
中有1个![]() 键,故
键,故![]() 中共有12个
中共有12个![]() 键,1
键,1![]() 中含
中含![]() 键;
键;
故答案为:![]() 或CO;12;
或CO;12;
![]() 为正四面体结构,C原子采取
为正四面体结构,C原子采取![]() 杂化,
杂化,![]() 为平面结构,C原子采取
为平面结构,C原子采取![]() 杂化,碳原子的杂化类型转化过程为:
杂化,碳原子的杂化类型转化过程为:![]() 杂化转化为
杂化转化为![]() 杂化;
杂化;![]() 分子中1s与1s电子云重叠形成
分子中1s与1s电子云重叠形成![]() 键,从共价键重叠方式看,
键,从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为
键类型为![]() 键;甲烷分子中键角为
键;甲烷分子中键角为![]() ,乙烯中键角约是
,乙烯中键角约是![]() ,
,![]() 的键角比
的键角比![]() 的键角小;
的键角小;
故答案为:![]() 杂化转化为
杂化转化为![]() 杂化;
杂化;![]() 键;小;
键;小;
![]() 图1中体心Fe原子与位于顶点的Fe原子相邻,Fe原子配位数为8;图2中Fe原子处于面心、顶点,属于面心立方最密堆积;
图1中体心Fe原子与位于顶点的Fe原子相邻,Fe原子配位数为8;图2中Fe原子处于面心、顶点,属于面心立方最密堆积;
故答案为:8;面心立方最密堆积;
![]() 原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线处于晶胞体对角线上,距离等于晶胞体对角线长度的
原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线处于晶胞体对角线上,距离等于晶胞体对角线长度的![]() ,而晶胞体对角线长度等于晶胞棱长的
,而晶胞体对角线长度等于晶胞棱长的![]() 倍,晶胞中C原子数目
倍,晶胞中C原子数目![]() ,Si原子数目
,Si原子数目![]() ,晶胞质量
,晶胞质量![]() ,晶胞体积
,晶胞体积![]()
![]()
![]() ,晶胞棱长
,晶胞棱长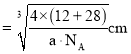 ,故碳化硅晶体内碳硅键的键长
,故碳化硅晶体内碳硅键的键长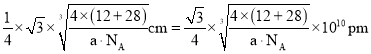 ;
;
故答案为: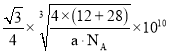 ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )

A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞失去大部分水分后,C 的所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
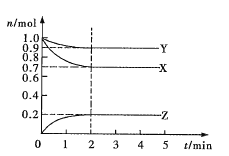
(1)该反应的化学方程式为______________。
(2)反应开始至2min,用Z表示的平均反应速率为_________。
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗![]() X,同时生成
X,同时生成![]() Z
Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的还原产物是______;
(2)该反应的平衡常数表达式为K=____________;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);若已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,则N2消耗速率为
(CO)=18molL﹣1min﹣1,则N2消耗速率为![]() (N2)=_________;
(N2)=_________;
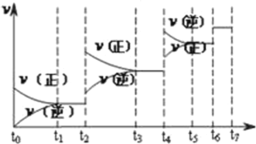
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO__FeO(填“>,<或=”),原因是_________。
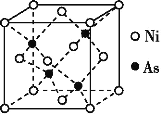
(3)NiAs的晶胞结构如图所示:
①Ni的配位数为____。
②若阿伏伽德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞中最近的Ni之间的距离为______cm。(写出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,向同温、同体积的三个真空密闭容器中分别充入气体:
,向同温、同体积的三个真空密闭容器中分别充入气体:![]() 甲
甲![]() 和
和![]() ;
;![]() 乙
乙![]() 和
和![]() ;
;![]() 丙
丙![]() ;恒温、恒容下反应达平衡时,下列关系一定正确的是
;恒温、恒容下反应达平衡时,下列关系一定正确的是![]()
A.容器内压强p:![]()
B.![]() 的质量m:
的质量m:![]()
C.![]() 与
与![]() 之比k:
之比k:![]()
D.反应放出或吸收热量的数值Q:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com