
【题目】已知:![]() ,向同温、同体积的三个真空密闭容器中分别充入气体:
,向同温、同体积的三个真空密闭容器中分别充入气体:![]() 甲
甲![]() 和
和![]() ;
;![]() 乙
乙![]() 和
和![]() ;
;![]() 丙
丙![]() ;恒温、恒容下反应达平衡时,下列关系一定正确的是
;恒温、恒容下反应达平衡时,下列关系一定正确的是![]()
A.容器内压强p:![]()
B.![]() 的质量m:
的质量m:![]()
C.![]() 与
与![]() 之比k:
之比k:![]()
D.反应放出或吸收热量的数值Q:![]()
【答案】A
【解析】
恒温恒容,甲与乙起始n(SO2):n(O2)=2:1,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,转化率增大;丙按化学计量数转化到左边可得n(SO2)=2mol,n(O2)=1mol,与甲为等效平衡,平衡时对应个组分的物质的量相等,
A. 甲与丙为等效平衡,平衡时对应个组分的物质的量相等,故压强P甲=P丙,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故P乙<P甲<2P乙;
B. 甲与丙为等效平衡,平衡时对应个组分的物质的量相等,故压强m甲=m丙,甲等效为在乙到达平衡的基础上,再加入1mol SO2和0.5mol O2,增大压强,平衡向正反应移动,SO2转化率增大,m甲>2m乙;
C. 对于甲、乙,SO2、O2起始物质的量之比等于化学计量数之比,c(SO2)与c(O2)之比为定值2:1,丙为分解反应,丙中c(SO2)与c(O2)之比为2:1,故k甲=k丙=k乙=2:1;
D. 甲与丙为等效平衡,平衡时对应个组分的物质的量相等,故Q甲+Q丙=197,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,SO2转化率增大,故Q甲>2Q乙。
![]() 甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故压强
甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故压强![]() ,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故容器内压强P:
,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故容器内压强P:![]() ,故A正确;
,故A正确;
B.甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故质量![]() ,甲等效为在乙到达平衡的基础上,再加入1mol
,甲等效为在乙到达平衡的基础上,再加入1mol ![]() 和
和![]()
![]() ,增大压强,平衡向正反应移动,
,增大压强,平衡向正反应移动,![]() 转化率增大,
转化率增大,![]() ,故
,故![]() 的质量m:
的质量m:![]() ,故B错误;
,故B错误;
C.对于甲、乙,![]() 、
、![]() 起始物质的量之比等于化学计量数之比,
起始物质的量之比等于化学计量数之比,![]() 与
与![]() 之比为定值2:1,丙为分解反应,丙中
之比为定值2:1,丙为分解反应,丙中![]() 与
与![]() 之比为2:1,故
之比为2:1,故![]() ,故C错误;
,故C错误;
D.由于甲和丙是从相反方向到达的等效平衡,所以反应放出或吸收热量的数值Q:![]() ,故D错误;
,故D错误;
故选A。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)铁晶体有两种晶胞,如图1、图2所示。
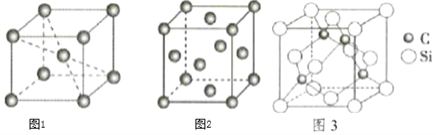
图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2 SO2(g)+O2(g)![]() 2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
A. 升高温度,可以加快反应速率
B. 在上述条件下,SO2不能完全转化为SO3
C. 使用催化剂是为了加快反应速率
D. 达到平衡时,SO2的浓度与SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn +2K2FeO4+8H2O =3Zn(OH)2 +2Fe(OH)3 +4KOH。下列叙述正确的是( )
A.放电时,正极区溶液的pH减小
B.放电时,负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三氯化铁的熔点为![]() ,沸点为
,沸点为![]() ,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:

(1)装碱石灰的仪器是_________(填仪器名称)。
(2)装置的连接顺序为____________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①固体混合物的成分是____________。(填化学式)
②淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为________。
(4)已知红色褪去的同时有气体生成,经检验为![]() 。该小组内的同学们对红色褪去的原因提出了三种假设。
。该小组内的同学们对红色褪去的原因提出了三种假设。
假设Ⅰ:![]() 还原
还原![]() ,使其转变为
,使其转变为![]() ;
;
假设Ⅱ:![]() 分解生成
分解生成![]() ,
,![]() 氧化试剂X;
氧化试剂X;
假设Ⅲ:_______。(如果表达中遇到试剂X,请写出其化学式)。
并对假设进行了以下实验研究:
①取褪色后溶液三份,第一份滴加![]() 溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和
溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
②另取同浓度的 ![]() 溶液滴加2滴试剂X,溶液变红,再通入
溶液滴加2滴试剂X,溶液变红,再通入![]() ,无明显变化。实验①说明假设__________不正确;由实验①②得出假设________是正确的。
,无明显变化。实验①说明假设__________不正确;由实验①②得出假设________是正确的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是__________________________(用化学方程式表示),所以他认为应该检验__________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
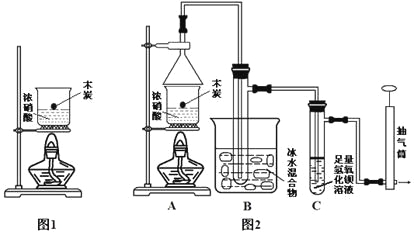
(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_______。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用____________________________________。
(4)C装置中出现的现象是_______________________________________________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在模拟工业制备和提纯硅时,利用氯气、石英砂和碳粉等原料按以下装置制备了SiCl4。已知SiCl4熔点-70°C,沸点57.6°C,遇水极易水解。

下列说法不正确的是( )
A.实验所用氯气等原料必须预先干燥处理
B.两通管中发生的化学反应为SiO2+C+2Cl2![]() SiCl4+CO2
SiCl4+CO2
C.液体X的作用是液化SiCl4气体,可以选择冰水等作冷却剂
D.若缺少固体Y的装置,实验时Z中可能会出现大量的白色烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g) ![]() cC(g)。平衡时测得A的浓度为0.5 mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28 mol/L。下列有关判断不正确的是( )
cC(g)。平衡时测得A的浓度为0.5 mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28 mol/L。下列有关判断不正确的是( )
A.a+b>cB.C的体积分数增大
C.该变化使平衡逆向移动D.B的转化率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com