
【题目】下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石![]() 碳化硅
碳化硅![]() 晶体硅
晶体硅
C.晶格能由大到小:NaF>NaCl>NaBr>NaI
D.熔点由高到低:Na>Mg>Al
【答案】D
【解析】
A. 组成和结构相似的分子晶体,相对分子质量越大,熔沸点越大;
B. 键长越短,共价键越强,硬度越大;
C. 离子半径越小、离子键越强,则晶格能越大;
D. 金属离子的电荷越大、半径越小,其熔点越大。
A.分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由低到高顺序为CF4<CCl4<CBr4<CI4,A项正确,不符合题意;
B. 键长越短,共价键越强,硬度越大,键长C-C<C-Si<Si-Si,则硬度由大到小为金刚石![]() 碳化硅
碳化硅![]() 晶体硅,故B正确,不符合题意;
晶体硅,故B正确,不符合题意;
C. 离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,C项正确,不符合题意;
D. 金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为Al>Mg>Na,D项错误,符合题意。
答案选D。


科目:高中化学 来源: 题型:
【题目】常温下联氨(N2H4)的水溶液中有:
①N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
②N2H5++H2O![]() N2H62++OH- K2
N2H62++OH- K2
(提示:二元弱碱的电离也是分步电离)
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是( )
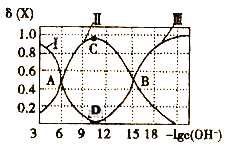
A.据A点可求:K1=10-6
B.D点溶液的c(OH-)=10-l1
C.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+)+2c(N2H62+)
D.在N2H5Cl水溶液中,c(N2H4)+c(OH-)=2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。
(2)Fe的基态原子有________个未成对电子,Fe3+的电子排布式为__________________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为__________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1mol乙醛分子中含有的σ键的数目为__________。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度_________________________________________________g/cm3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的还原产物是______;
(2)该反应的平衡常数表达式为K=____________;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);若已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,则N2消耗速率为
(CO)=18molL﹣1min﹣1,则N2消耗速率为![]() (N2)=_________;
(N2)=_________;
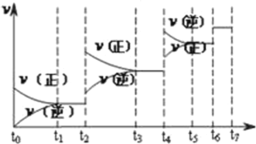
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号,其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.R原子的核外电子排布图为![]()
B.Y2-与Na+的半径大小关系为Y2->Na+
C.X的第一电离能小于Y的第一电离能
D.表中电负性最大的元素为W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 现有一组物质的熔点(℃)数据,据此回答下列问题:
HF:-83 | HCl:-115 | HBr:-89 | HI:-51 |
(1)HF熔点反常是由于______________。这组物质中共价键的键能最大的是_____。
II.按要求回答下列问题。
(2)CS2气化时克服的粒子间作用是__________,1mol CS2中含有___mol σ键,含有___mol π键。
(3)HCHO分子中C原子轨道的杂化类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组对金属钠进行研究。已知C、D都是单质,F的水溶液是一种常见的强酸。

(1)金属Na在空气中放置足够长时间,最终的生成物是:_________________________。
(2)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出该过程中发生氧化还原反应的化学方程式:_________________________。
(4)若A是一种溶液,只可能含有H+、NH![]() 、Mg2+、Fe3+、Al3+、CO
、Mg2+、Fe3+、Al3+、CO![]() 、SO
、SO![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为_________。
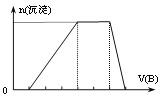
(5)将NaHCO3与M的混合物在密闭容器中充分加热后排出气体,经测定,所得固体为纯净物,则NaHCO3与M的质量比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com