
【题目】某课外小组对金属钠进行研究。已知C、D都是单质,F的水溶液是一种常见的强酸。

(1)金属Na在空气中放置足够长时间,最终的生成物是:_________________________。
(2)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出该过程中发生氧化还原反应的化学方程式:_________________________。
(4)若A是一种溶液,只可能含有H+、NH![]() 、Mg2+、Fe3+、Al3+、CO
、Mg2+、Fe3+、Al3+、CO![]() 、SO
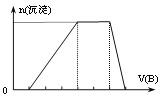
、SO![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为_________。
(5)将NaHCO3与M的混合物在密闭容器中充分加热后排出气体,经测定,所得固体为纯净物,则NaHCO3与M的质量比为____________。
【答案】碳酸钠 或Na2CO3 溶液中逐渐有白色絮状沉淀生成且不断增加;然后又由多到少最后沉淀消失。 4Fe(OH)2+O2+2H2O==4Fe(OH)3 c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3 ≥84:39
【解析】
由转化关系图可知,M为Na2O2,C、D都是单质,Na与水反应生成C,则C为H2,B为NaOH,F的水溶液是一种常见的强酸,则F为HCl,D为Cl2,若A是一种常见金属单质,则A为Al,E为NaAlO2,G为NaCl;若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A为FeCl2,E为Fe(OH)3;若A是一种溶液,由图可知,开始发生酸碱中和,然后Al3+与碱反应,再NH4+与碱反应,最后沉淀与碱反应完全溶解,然后结合物质的性质及反应来解答。
(1)Na在空气中放置足够长时间,发生4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,则最终生成物为碳酸钠或Na2CO3;答案为碳酸钠或Na2CO3。
(2)若A是一种常见金属单质,则A为Al,E为NaAlO2,G为NaCl,将过量的F溶液逐滴加入E溶液,边加边振荡,发生NaAlO2+HCl+H2O=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,所看到的实验现象是:溶液中逐渐有白色絮状沉淀生成且不断增加,然后又由多到少最后沉淀消失;答案为:溶液中逐渐有白色絮状沉淀生成且不断增加,然后又由多到少最后沉淀消失。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A为FeCl2,E为Fe(OH)3,则A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,该过程中发生氧化还原反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;答案为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)若A是一种溶液,由图可知,开始发生酸碱中和,然后Al3+与碱反应,再NH4+与碱反应,最后沉淀与碱反应完全溶解,则溶液中不存在Fe3+、Mg2+,有H+和Al3+,不存在CO32-,因而该溶液中含H+、NH4+、Al3+,由离子共存及电荷守恒可知,还存在的阴离子为SO42-,由消耗B的体积可知,c(H+):c(Al3+):c(NH4+)=1:1:2,由电荷守恒可知c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3;答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。
(5)由2NaHCO3![]() Na2CO3+CO2↑+H2O、2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑、CO2+2NaOH=Na2CO3+H2O可知,充分加热后排出气体,经测定,所得固体为纯净物,则生成物只有Na2CO3,即n(NaHCO3):n(Na2O2) ≥2:1,NaHCO3与M的质量比为≥84:39;答案为≥84:39。
Na2CO3+CO2↑+H2O、2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑、CO2+2NaOH=Na2CO3+H2O可知,充分加热后排出气体,经测定,所得固体为纯净物,则生成物只有Na2CO3,即n(NaHCO3):n(Na2O2) ≥2:1,NaHCO3与M的质量比为≥84:39;答案为≥84:39。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石![]() 碳化硅
碳化硅![]() 晶体硅
晶体硅
C.晶格能由大到小:NaF>NaCl>NaBr>NaI
D.熔点由高到低:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中通入2mol NH3,在一定温度下发生下列反应:2NH3![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内
N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内![]() 的百分含量也为a%的是( )
的百分含量也为a%的是( )
A.3mol H2+2mol N2B.2mol NH3+1mol N2
C.3mol N2+1mol H2D.0.lmol NH3+0.95mol N2+2.85mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I已知:还原性HSO![]() >I-,氧化性IO
>I-,氧化性IO![]() > I2 。
> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目_______。
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式_______;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为_______mol。

II 已知:KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2、KHSO4等物质。写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是__________________________(用化学方程式表示),所以他认为应该检验__________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
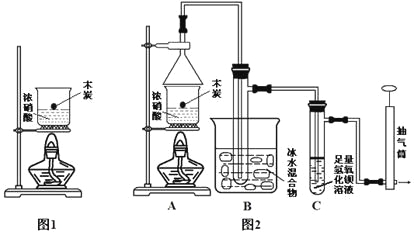
(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_______。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用____________________________________。
(4)C装置中出现的现象是_______________________________________________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯![]() 是广泛用于电子行业的强磁性材料.
是广泛用于电子行业的强磁性材料.![]() 为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于
为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于![]() 开始分解。
开始分解。
Ⅰ![]() 实验室以
实验室以![]() 为原料制备
为原料制备![]()
![]() 制备
制备![]() 溶液:
溶液:
![]() 主要反应装置如图1,缓缓通入经
主要反应装置如图1,缓缓通入经![]() 稀释的
稀释的![]() 气体,发生反应
气体,发生反应![]() ,下列措施中,目的是加快化学反应速率的是______
,下列措施中,目的是加快化学反应速率的是______![]() 填标号
填标号![]() 。
。
A.![]() 加入前先研磨
加入前先研磨![]() 搅拌
搅拌![]() 提高混合气中
提高混合气中![]() 比例
比例
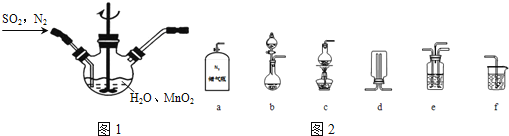
![]() 已知实验室制取
已知实验室制取![]() 的原理是
的原理是![]() 浓
浓![]()
![]()
![]() 选择如图2所示部分装置与图装1置相连制备
选择如图2所示部分装置与图装1置相连制备![]() 溶液,应选择的装置有______
溶液,应选择的装置有______![]() 填标号
填标号![]() .
.
![]() 若用空气代替
若用空气代替![]() 进行实验,缺点是______
进行实验,缺点是______![]() 酸性环境下
酸性环境下![]() 不易被氧化
不易被氧化![]()
![]() 制备
制备![]() 固体:
固体:
实验步骤:![]() 向
向![]() 溶液中边搅拌边加入饱和
溶液中边搅拌边加入饱和![]() 溶液生成
溶液生成![]() 沉淀,反应结束后过滤;
沉淀,反应结束后过滤;![]() ;
;![]() 在
在![]() 下烘干得到纯净干燥的
下烘干得到纯净干燥的![]() 固体。
固体。
步骤![]() 需要用到的试剂有______。
需要用到的试剂有______。
Ⅱ![]() 设计实验方案
设计实验方案
![]() 利用沉淀转化的方法证明
利用沉淀转化的方法证明![]() :______
:______![]() 已知
已知![]() 为难溶于水的浅绿色固体
为难溶于水的浅绿色固体![]()
![]() 证明
证明![]() 的第二步电离不完全:______
的第二步电离不完全:______![]() 查阅资料表明
查阅资料表明![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为![]() 的密闭容器中充入
的密闭容器中充入![]() 气体和
气体和![]() 气体,在一定条件下发生如下反应:
气体,在一定条件下发生如下反应:![]() ;经
;经![]() 后达到平衡,测得C气体的浓度为
后达到平衡,测得C气体的浓度为![]() 。下列说法中正确的是
。下列说法中正确的是![]()
![]()
①用物质A表示该反应的平均反应速率为![]()
②用物质B表示该反应的平均反应速率为![]()
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为![]()
⑤其他条件不变,向容器中再加入![]() 气体,达到新平衡时,C的体积分数不变
气体,达到新平衡时,C的体积分数不变
A.①②③B.①③⑤C.③④⑤D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2molL-1。下列判断错误的是
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2molL-1。下列判断错误的是
A. x=1B. 若混合气体的密度不变则表明该反应达到平衡状态
C. B的转化率为40%D. 2min内A的反应速率为0.3molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com