
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
【答案】16 8mol 5∶4 2∶3 3∶3∶2
【解析】
(1)根据三段式结合时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol计算;
(2)根据n=![]() 计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)利用差量法计算原混合气体的物质的量;
(4)原混合气体的物质的量-氮气的物质的量=氢气的物质的量,据此计算;
(5)计算出达到平衡时,反应混合物各组分的物质的量,据此计算。
(1) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol): a b 0
转化(mol): 3 96
t时刻(mol):a-3 b-9 6
则a-3=13,解得:a=16,故答案为:16;
(2)反应达平衡时,混合气体为![]() =32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
=32mol,其中NH3的物质的量为32mol×25%=8mol,故答案为:8mol;
(3) N2(g)+3H2(g)![]() 2NH3(g),物质的量减少△n
2NH3(g),物质的量减少△n
开始:1mol3mol 2mol 2mol
转化:4mol12mol 8mol 8mol
气体的减少量与生成的氨气相等,故原混合气体为32mol+8mol=40mol,则原混合气体与平衡混合气体的物质的量之比n(始)∶n(平)=40mol∶32mol=5∶4,故答案为:5∶4;
(4)由(1)知a=16mol,则b=40mol-16mol=24mol,所以a∶b=16mol∶24mol=2∶3,故答案为:2∶3;
(5)平衡混合气的组成为:N212mol,H212mol,NH3为8mol,平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=12mol∶12mol∶8mol=3∶3∶2,故答案为:3∶3∶2。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】对SCN-的性质进行探究,设计了以下实验
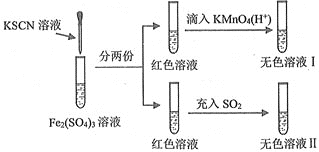
已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( )
A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.红色溶液褪色表现了SO2的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化碘![]() 的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式为IBr+H2O=HBr+HIO。下列有关IBr的叙述中,不正确的是( )
的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式为IBr+H2O=HBr+HIO。下列有关IBr的叙述中,不正确的是( )
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.IBr和NaOH溶液反应生成NaBr和NaIO
D.IBr和水反应时,既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:

(1)②的元素符号是__________;该元素的最高价氧化物的电子式为__________;
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤________⑥(填“>”或“<”);
(3)①和③两种元素组成的化合物中含有的化学键为__________(填“离子键”或“共价键”)
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )

A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞失去大部分水分后,C 的所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下联氨(N2H4)的水溶液中有:
①N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
②N2H5++H2O![]() N2H62++OH- K2
N2H62++OH- K2
(提示:二元弱碱的电离也是分步电离)
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是( )
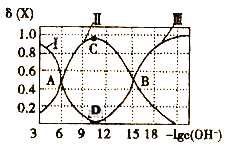
A.据A点可求:K1=10-6
B.D点溶液的c(OH-)=10-l1
C.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+)+2c(N2H62+)
D.在N2H5Cl水溶液中,c(N2H4)+c(OH-)=2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
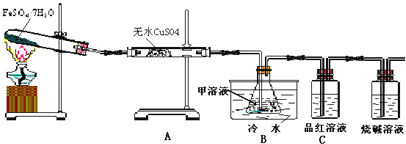
(1)用于检验SO2气体的装置是______(填装置的字母),确认水蒸气存在的现象是______;
(2)利用装置B可以确认的产物是______,装置B中的甲溶液可选(填序号)______。
①足量澄清石灰水②足量氯化钡溶液③足量硝酸钡溶液
该装置中冷水的作用是______;
(3)为探究Fe2O3的性质和用途,取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为______,检验该分散系最简方法的操作为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的还原产物是______;
(2)该反应的平衡常数表达式为K=____________;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);若已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,则N2消耗速率为
(CO)=18molL﹣1min﹣1,则N2消耗速率为![]() (N2)=_________;
(N2)=_________;
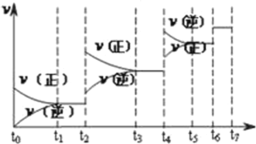
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com