【答案】
分析:(1)氯化铵和氢氧化钙在加热条件下能反应生成氯化钙、氨气和水;氨气有还原性,次氯酸钠有强氧化性,所以氨气能被次氯酸钠氧化成N
2H
4.
(2)①根据氧化钙和水反应生成碱,且该反应放热;氨水能电离出氢氧根离子,也能分解为氨气和水,二者结合分析.
②氯化氢和氨气能生成氯化铵固体而呈现白烟,氨气能使湿润的红色石蕊试纸变蓝,据此分析.
(3)利用氨气极易溶于水,形成压强差而形成喷泉,
根据相同条件下m=VMV
m知,烧瓶中氨气与氢气的摩尔质量之比,然后根据十字相乘法得出氨气和空气的体积之比.
解答:解:(1)氯化铵和氢氧化钙在加热条件下能反应生成氯化钙、氨气和水2NH
4Cl+Ca(OH)
2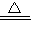
CaCl
2+2NH
3↑+2H
2O;氨气有还原性,次氯酸钠有强氧化性,所以氨气能被次氯酸钠氧化成N
2H
4,离子方程式为:ClO
-+2NH
3═N
2H
4+Cl
-+H
2O.
故答案为:2NH
4Cl+Ca(OH)
2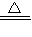
CaCl
2+2NH
3↑+2H
2O;ClO
-+2NH
3═N
2H
4+Cl
-+H
2O;
(2)①NH
3?H
2O?NH
4++OH
-,NH
3?H
2O
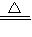
NH
3↑+H
2O;CaO+H
2O=Ca(OH)
2,氧化钙和水反应生成碱同时放出大量热,均有利于氨气逸出;
②用玻璃棒蘸取少许浓盐酸靠近收集NH
3的试管口,若产生白烟,说明试管已收集满NH
3,反之,则没有收集满或用湿润的红色石蕊试纸靠近收集NH
3的试管口,若湿润的红色石蕊试纸变蓝,则说明NH
3已收集满,反之,则没有收集满.
故答案为:①NH
3?H
2O?NH
4++OH
-,NH
3?H
2O
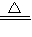
NH
3↑+H
2O;CaO+H
2O=Ca(OH)
2,氧化钙和水反应生成碱同时放出大量热,均有利于氨气逸出;②用玻璃棒蘸取少许浓盐酸靠近收集NH
3的试管口,若产生白烟,说明试管已收集满NH
3,反之,则没有收集满或用湿润的红色石蕊试纸靠近收集NH
3的试管口,若湿润的红色石蕊试纸变蓝,则说明NH
3已收集满,反之,则没有收集满.
3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉;
相同条件下m=VMV
m知,烧瓶中的氨气与氢气的摩尔质量之比等于其质量之比,所以烧瓶中氨气的平均摩尔质量为20g/mol,空气的平均摩尔质量是29g/mol,氨气的摩尔质量是17g/mol,烧瓶中氨气和空气的摩尔质量之差和空气与氨气摩尔质量之差的比即为氨气和空气的体积之比.
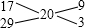
,所以氨气和空气的体积之比为9:3=3:1,所以烧瓶中水可上升至烧瓶容积的

.
故答案为:打开止水夹挤出胶头滴管中的水;NH
3极易溶解于水,致使烧瓶内压强迅速减小;

.
点评:本题考查氨气的制备和性质,题目难度不大,本题注意形成喷泉的原理和操作方法.


 CaCl2+2NH3↑+2H2O;氨气有还原性,次氯酸钠有强氧化性,所以氨气能被次氯酸钠氧化成N2H4,离子方程式为:ClO-+2NH3═N2H4+Cl-+H2O.
CaCl2+2NH3↑+2H2O;氨气有还原性,次氯酸钠有强氧化性,所以氨气能被次氯酸钠氧化成N2H4,离子方程式为:ClO-+2NH3═N2H4+Cl-+H2O. CaCl2+2NH3↑+2H2O;ClO-+2NH3═N2H4+Cl-+H2O;
CaCl2+2NH3↑+2H2O;ClO-+2NH3═N2H4+Cl-+H2O; NH3↑+H2O;CaO+H2O=Ca(OH)2,氧化钙和水反应生成碱同时放出大量热,均有利于氨气逸出;
NH3↑+H2O;CaO+H2O=Ca(OH)2,氧化钙和水反应生成碱同时放出大量热,均有利于氨气逸出; NH3↑+H2O;CaO+H2O=Ca(OH)2,氧化钙和水反应生成碱同时放出大量热,均有利于氨气逸出;②用玻璃棒蘸取少许浓盐酸靠近收集NH3的试管口,若产生白烟,说明试管已收集满NH3,反之,则没有收集满或用湿润的红色石蕊试纸靠近收集NH3的试管口,若湿润的红色石蕊试纸变蓝,则说明NH3已收集满,反之,则没有收集满.
NH3↑+H2O;CaO+H2O=Ca(OH)2,氧化钙和水反应生成碱同时放出大量热,均有利于氨气逸出;②用玻璃棒蘸取少许浓盐酸靠近收集NH3的试管口,若产生白烟,说明试管已收集满NH3,反之,则没有收集满或用湿润的红色石蕊试纸靠近收集NH3的试管口,若湿润的红色石蕊试纸变蓝,则说明NH3已收集满,反之,则没有收集满.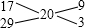 ,所以氨气和空气的体积之比为9:3=3:1,所以烧瓶中水可上升至烧瓶容积的
,所以氨气和空气的体积之比为9:3=3:1,所以烧瓶中水可上升至烧瓶容积的 .
. .
.




