
【题目】下列判断正确的是( )
①足量金属![]() 与标准状况下
与标准状况下![]() 反应时一定转移2 mol电子
反应时一定转移2 mol电子
②金属与氧气反应时都生成最高价金属氧化物
③金属钠与![]() 反应生成
反应生成![]() ,金属铜也能与
,金属铜也能与![]() 反应生成
反应生成![]()
④![]() 与足量
与足量![]() 反应时,每生成
反应时,每生成![]() 转移电子的数目为
转移电子的数目为![]()
⑤![]() 遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
⑥向饱和烧碱溶液中加入![]() ,充分反应后,恢复至原温度,溶液中
,充分反应后,恢复至原温度,溶液中![]() 不变
不变
A.①②③B.②③⑤C.②④⑥D.④⑥
【答案】D
【解析】
①足量金属![]() 与标准状况下
与标准状况下![]() 反应生成Na2O时一定转移2 mol电子,生成Na2O2时只转移1mol电子,故错误;
反应生成Na2O时一定转移2 mol电子,生成Na2O2时只转移1mol电子,故错误;
②金属与氧气反应时不一定生成最高价金属氧化物,如铁与氧气生成四氧化三铁,故错误;
③金属钠的活泼性比氢强,金属钠与![]() 反应生成
反应生成![]() ,但金属铜的活泼性比氢弱,金属铜不能与
,但金属铜的活泼性比氢弱,金属铜不能与![]() 反应生成
反应生成![]() ,故错误;
,故错误;
④![]() 与足量
与足量![]() 反应时,2Na2O2+2H2O=4NaOH+O2↑每生成
反应时,2Na2O2+2H2O=4NaOH+O2↑每生成![]() 转移电子的数目为
转移电子的数目为![]() ,故正确;
,故正确;
⑤2Na2O2+2H2O=4NaOH+O2↑,Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸先变成蓝色,后褪色,故错误;
⑥向饱和烧碱溶液中加入![]() ,充分反应后,恢复至原温度,仍然是饱和溶液,溶液中
,充分反应后,恢复至原温度,仍然是饱和溶液,溶液中![]() 不变,故正确;
不变,故正确;
故选D.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为
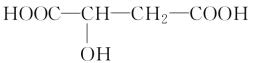
下列相关说法不正确的是( )。
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下)
D.1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
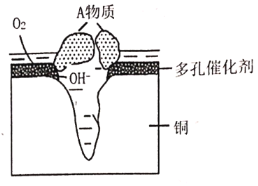
(1)该粉状锈中除了铜元素外还含有(写元素符号)___元素,该铜制品发生电化学腐蚀生成粉状锈时其正极电极反应式为____。
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42- ===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【答案】D
【解析】A. 氯化铁溶液中的铁离子具有氧化性,能够氧化碘离子,与碘化钾溶液反应的离子方程式为2Fe3++2I-===2Fe2++I2,故A错误;B. 硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为Ba2++SO![]() +2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH
+2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH![]() ,故D正确;故选D。
,故D正确;故选D。
【题型】单选题
【结束】
12
【题目】一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),能说明该反应达到化学平衡状态的是( )
2NH3(g),能说明该反应达到化学平衡状态的是( )
A. N2、H2、NH3的浓度相等 B. N2、H2、NH3的浓度不再变化
C. N2、H2、NH3在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
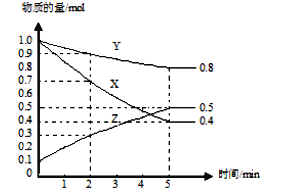
(1)该反应的化学方程式是_____________________________。
(2)该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
(3)计算2 min内,Y的转化率为_____________;用物质X表示反应的平均速率为___________;用物质Z表示反应的平均速率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同溶液进行如下实验,其中操作,现象和结论均正确的是( )
选项 | 操 作 | 现 象 | 结 论 |
A | 先向待测液滴加 | 生成白色沉淀,加酸后沉淀不溶解 | 原溶液中有 |
B | 先向待测液滴加2滴 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有 |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有 无 |
D | 向待测液滴足量的盐酸 | 将产生的气体通入足量澄清石灰水,溶液变浑浊 | 原溶液中有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物1-氧杂-2,4-环戊二烯(![]() )的说法正确的是
)的说法正确的是
A. 与![]() 互为同系物B. 二氯代物有3种
互为同系物B. 二氯代物有3种
C. 所有原子都处于同一平面内D. 1mol该有机物完全燃烧消耗5molO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com